Suomalaisia liikehäiriösairauksien ihmistutkimuksia vuonna 2023
Vuoden 2023 julkaisutietokannoista löytyi 47 kpl täysin tai pääosin suomalaisten tekemää kansainvälistä julkaisua, joissa tutkimus liittyi liikehäiriösairauksiin (potilas- tai muu ihmistutkimus). Määrä on pysynyt lähes ennallaan verrattuna vuoteen 2022.
Noin 65 % tutkimuksista käsitteli Parkinsonin tautia tai muita parkinsonismeja. Tämä on vähemmän kuin aiemmin ja merkitsee, että myös muita liikehäiriösairauksia tutkitaan Suomessa. Julkaisuja olikin dystoniasta, ataksiasta, Huntingtonin ja Wilsonin taudeista sekä Touretten oireyhtymästä. Toisin kuin moneen vuoteen nyt oli myös muutama julkaisu vapinasta. Tavallisimmat tutkimusalueet liittyivät rekisteritutkimuksiin, kuvantamiseen ja perintötekijöihin. Maantieteellisesti eniten tutkimuksia tehtiin Helsingin ja Turun yliopistojen ja yliopistosairaaloiden alueella, mutta myös muista yliopistoista (Kuopio, Oulu, Tampere) oli useampi julkaisu.
Sisällysluettelo
- Parkinsonin tauti, epidemiologia
- Parkinsonin tauti, kuvantaminen
- Parkinsonin tauti, lääketutkimukset
- Parkinsonin tauti, syväaivostimulaatio (DBS)
- Parkinsonin tauti, genetiikka
- Parkinsonin tauti, mikrobit
- Parkinsonin tauti, dyskinesiat
- Parkinsonin tauti, puhe
- Parkinsonin tauti, älylaitteet
- Parkinsonin tauti, kliininen testi
- Parkinsonin tauti, itsehoito
- Lewyn kappale -tauti
- Dystonia ja dyskinesia
- Ataksia
- Vapina
- Huntingtonin tauti
- Wilsonin tauti
- Touretten oireyhtymä
- Neuroepidemiologia
- Hemifasiaalispasmi
Parkinsonin tauti, epidemiologia
Kuopiolaisen prof. Anna-Maija Tolppasen ryhmä julkaisi viisi tutkimusta, joissa selvitettiin eräiden lääkkeiden käytön tai muun altistumisen yhteyttä Parkinsonin taudin syntyyn. Kaikki tutkimukset perustuvat suomalaisiin rekisteritietoihin (mm. Kela, THL, syöpärekisteri, tilastokeskus, väestörekisterikeskus). Parkinsonpotilaiden tietokanta perustuu FINPARK-tutkimukseen kerätystä potilastiedostosta.
Ensimmäisessä tutkimuksessa ryhmä havaitsi, että ei ole mitään varmaa yhteyttä ns. avaavien astmalääkkeiden käytön (beeta-agonisti -lääkkeet) ja Parkinsonin taudin synnyn välillä [1]. Tämä tulos eroaa joidenkin muiden tutkimusten tuloksista, joissa on havaittu astmalääkkeiden vähentävän Parkinsonin taudin riskiä. Suomalaisen tutkimuksen vahvuutena on hyvät rekisteritiedot ja sekoittavien tekijöiden huomioon ottaminen.
Toisessa tutkimuksessa ryhmä selvitteli, onko antipsykoottien aloittamisen ja sairaalaan joutumisen välillä yhteyttä parkinsonpotilailla [2]. Näillä potilailla antipsykootteja (kuten ketiapiinia, risperidonia, klotsapiinia) käytetään harhojen ja muiden psykoottisten oireiden hoidossa. Ryhmä havaitsi, että antipsykoottien käytön ja sairaalahoitoon joutumisen välillä oli selvä yhteys ja sairaalahoito oli pidempi antipsykootteja käyttävillä. Löydös kertonee siitä, että parkinsonpotilaiden neuropsykiatriset oireet vaativat usein sairaalahoitoa eikä pelkkä lääkityksen aloittaminen aiheuta sairaalahoitoa.
Kolmannessa tutkimuksessa ryhmä selvitteli parkinsonpotilaiden sydän- ja verenkiertolääkkeiden ja antikoagulanttien (ns. verenohennuslääkkeet) käyttöä [3]. Ennen Parkinsonin taudin diagnoosia potilaat käyttivät hieman enemmän sydän- ja verenkiertolääkkeitä ja antikoagulantteja, mutta sairastumisen jälkeen sydän- ja verenkiertolääkkeiden käyttö väheni. Sydänlääkkeistä tavallisin lääkeryhmä oli beetasalpaajat, joita voidaan käyttää mm. vapinan hoitoon. Parkinsonin taudin aiheuttama verenpaineen alentuminen (erityisesti pystyasennossa) voi olla syynä sydän- ja verenkiertolääkkeiden käytön vähentymiseen.
Neljännessä tutkimuksessa selvitettiin pään vammojen yleisyyttä parkinsonpotilailla [4]. Parkinsonin tautihan lisää kaatumisia ja siten oletettavasti myös pään vammojen määrä lisääntyy. Näin oli myös havaittavissa suomalaisessa aineistossa. Parkinsonin tauti lisäsi pään vammojen riskiä yli kaksinkertaiseksi ja vakavien aivovaurioiden riskiä lähes kaksinkertaiseksi. Myös kuolleisuus näihin vammoihin lisääntyi. Tämänkin tutkimuksen perusteella kaatumisten ennalta ehkäiseminen on erittäin tärkeää Parkinsonin taudissa.
Viidennessä tutkimuksessa ryhmä selvitteli ilman hiukkasaltistumisen ja Parkinsonin taudin synnyn välisiä yhteyksiä [5]. Ryhmä ei havainnut mitään varmaa yhteyttä ilman hiukkassaasteille altistumisen ja Parkinsonin taudin riskin välillä. Kyseessä on Suomen olosuhteet, joka ei välttämättä kuvaa koko maailman tilannetta.
Työterveyslaitoksen tutkijat selvittelivät liuotinainealtistuksen ja Parkinsonin tautiin sairastumisen riskiä [6]. Useammassa aiemmassa tutkimuksessa on havaittu liuotinainealtistuksen lisäävän riskiä sairastua Parkinsonin tautiin. Erityisesti trikloorietyleeni (TCE) on ollut tapetilla. Tässä suomalaisessa rekistereihin perustuvassa tutkimuksessa havaittiin liuotinainealtistuksen hieman lisäävän riskiä sairastua Parkinsonin tautiin, mutta riskin lisäys ei ollut tilastollisesti merkitsevä. Tupakoinnin havaittiin vähentävän riskiä, kuten monissa muissakin aiemmissa tutkimuksissa on havaittu. Suomessa altistumistasot lienevät aika matalat, joka voinee osaltaan selittää tulosten eroja eri tutkimusten välillä. Tällaisissa tutkimuksissa on monia sekoittavia tekijöitä, joita suomalaiset tutkijat pyrkivät ottamaan huomioon.
Dosentti Jussi Sipilä (Joensuu, Turku) kollegoineen tutki suomalaisten parkinsonpotilaiden kuolleisuutta [7]. Tutkimuksen aineistona oli vuosina 2004-2018 diagnosoidut Parkinsonin tautia sairastavat potilaat (23688 potilasta) perustuen KELAn lääkekorvaustilastoihin. Heitä verrattiin satunnaisesti valittuun ikää ja sukupuolta vastaavaan kontrolliryhmään (94752 henkilöä). Tutkijat havaitsivat, että suomalaisten parkinsonpotilaiden kuolleisuusriski oli yli kaksinkertainen verrattuna kontrolliryhmään (kuva 1.). Eniten kuolleisuus oli lisääntynyt nuorena sairastuneiden ryhmässä. Tavallisimmat kuolinsyyt olivat perustauti (Parkinsonin tauti), sydän- ja verisuonisairaudet ja syöpäsairaudet. Tutkimus osoittaa, että edelleenkin Parkinsonin tautiin liittyy lisääntynyttä kuolleisuutta, tosin monessa muussa ulkomaisessa tutkimuksessa riskin lisäys on jäänyt hieman pienemmäksi.

Kuva 1. Parkinsonpotilaiden eloonjääminen verrattuna kontrolleihin.
Parkinsonin tauti, kuvantaminen
Prof. Valtteri Kaasisen tutkimusryhmä Turusta havaitsi, että aivokuoren varhaisella surkastumisella (atrofialla) oli yhteys parkinsonismipotilaiden masennukseen [8]*. Tutkimuksessa oli mukana 50 menehtynyttä potilasta (30 Parkinsonin tautia sairastanutta, 10 etenevää supranukleaarista halvausta [PSP] sairastanutta ja 10 monisysteemiatrofiaa [MSA] sairastanutta. Diagnoosit oli varmistettu neuropatologisella tutkimuksella. Kaikille oli elinaikanaan tehty yksi-kaksi kertaa aivojen tietokonetomografiatutkimus, josta arvioitiin aivokuoren paksuutta. Masennusta arvioitiin sairauskertomustiedoista. Tutkijat havaitsivat, että erityisesti ohimolohkon atrofia oli selvempää masennuksesta kärsivillä parkinsonismipotilailla ja että heillä myös aivokuoren surkastuminen oli nopeampaa. Tutkimuksen perusteella ei pysty sanomaan, kumpi on syy ja kumpi on seuraus eli aiheuttaako masennus aivojen surkastumista vai johtaako aivojen surkastuminen masennukseen. Samantapaisia löydöksiä on havaittu myös muilla masennuspotilailla.
Väitöskirjaansa valmisteleva Imran Waggan prof. Juha Rinteen ryhmästä Turusta julkaisi kaksi aivojen PET-tutkimusta, jossa merkkiaineena käytettiin yhdistettä ([11C]TMSX), joka sitoutuu aivojen adenosiini 2A-reseptoreihin. Tähän reseptoriin sitoutuu myös mm. kofeiini. Ensimmäisessä tutkimuksessa oli mukana 18 parkinsonpotilasta ja 7 kontrollihenkilöä [9]*. Tutkijat havaitsivat, että adenosiini 2A-reseptorien määrä oli lisääntynyt otsa- ja päälaenlohkon valkeassa aineessa, mutta vähentynyt näköaivokuoren harmaassa aineessa. Toisessa tutkimuksessa oli mukana 9 varhaisvaiheen parkinsonpotilasta, 9 keskivaiheen parkinsonpotilasta ja 6 tervettä kontrollihenkilöä [10]*. Tutkijat havaitsivat, että parkinsonpotilailla adenosiini 2A-reseptorien määrä oli vähentynyt häntätumakkeessa (kaudatus-tumake) ja lisääntynyt pallidum-tumakkeessa. Molemmat tutkimukset kuuluvat enemmän perustutkimuksen piiriin ja niiden käytännön merkitys jää vielä avoimeksi.
Helsinkiläisten ja turkulaisten neurologien tekemässä tutkimuksessa selvitettiin parkinsonpotilaiden suolisto-oireiden ja aivojen dopamiinitransportterimuutosten välisiä yhteyksiä [11]. Dopamiinitransportteritutkimus on isotooppitutkimus (Spect-tutkimus) ja se mittaa välillisesti dopamiiniratojen määrää eri aivoalueilla. Mukana oli 90 parkinsonpotilasta, joille tehtiin Spect-tutkimuksen ohella kliininen arvio ja erilaisia suolisto-oirekyselyjä. Tutkimuksessa löytyi 17 potilasta, jotka täyttivät ärtyvän paksunsuolen -oireiston kriteerit. Heillä oli oikeassa putamen-tumakkeessa ja sen ympäristössä lisääntynyt transportterisitoutuminen. Tutkimus osoittaa omalta osaltaan, että aivojen muutoksilla ja suolisto-oireilla on yhteyksiä, vaikkakin tarkempi merkitys jää avoimeksi.
Prof. Juho Joutsa Turusta oli mukana kansainvälisessä katsausartikkelissa, jossa käytiin läpi parkinsonismista julkaistut kuvantamistutkimukset (yhteensä 44591 tutkimusta). Lopulliseen arvioon jäi 132 tutkimusta, joissa oli käytettävissä magneetti (MRI)-, PET- ja Spect-kuvatietoja [12]. Tutkijat tekivät yhteenvedon niistä tyypillistä aivomuutoksista, joita on havaittavissa Parkinsonin taudissa, supranukleaarisessa halvauksessa (PSP), kortikobasaalisessa rappeumassa (CBD) ja monisysteemiatrofiassa (MSA). Tiedot ovat hyödyllisiä erityisesti liikehäiriösairauksia hoitaville neurologeille ja kuvia tulkitseville radiologeille ja isotooppilääkäreille.
Turkulaiset tutkijat selvittivät, mitkä olisivat sopivimmat elektrodien paikat EEG-tutkimuksessa (aivosähkökäyrätutkimus) varhaisen Parkinsonin taudin löytämiseen [13]. EEG-rekisteröintejä oli sekä suomalaisista että amerikkalaisista potilaista. Tutkijat havaitsivat, että supistetulla elektrodimäärällä (5 kanavaa) saadaan tarpeeksi luotettavaa tietoa. Nähtäväksi jää, soveltuuko menetelmä varhaisvaiheiden potilaiden luotettavaan seulontaan.
Parkinsonin tauti, lääketutkimukset
Suomalaiset ja ruotsalaiset neurologit ja neurokirurgit yhdessä Herantis Pharman tutkijoiden kanssa julkaisivat hermokasvutekijä CDNF:llä tehdyn potilastutkimuksen tulokset [14]. CDNF (Cerebral dopamine neurotrophic factor) on prof. Mart Saarman ryhmän löytämä hermojen kasvutekijä, jolla on saatu lupaavia tuloksia Parkinsonin taudin eläinmalleissa. Herantis Pharma on suomalainen lääkekehitysyritys, jonka tutkijat yhdessä suomalaisten, ruotsalaisten ja englantilaisten neurologien ja neurokirurgien kanssa suunnittelivat ensimmäisen potilailla tehdyn CDNF-tutkimuksen. Koska CDNF on annettava suoraan aivokudokseen, kyseessä oli varsin monimutkainen lääkkeen annostusmenetelmä, jossa kalloon asetettiin pysyvä putkisto, jonka kautta CDNF annettiin kuukausittain. Ensimmäisen 6 kuukauden aikana potilaat saivat joka lumelääkettä tai kahta eri suuruista annosta CDNF:ä. Toisen 6 kuukauden jakson aikana kaikki potilaat saivat CDNF:ä. Mukana oli 17 potilasta. Ruiskutukset onnistuivat eikä mitään vakavaa CDNF:ään liittyvää haittaa havaittu. Infuusiolaitteistoon liittyi kaksi aivon märkäpesäkkeen kehittymistä, jotka saatiin onnistuneesti hoidettua, kun laitteisto poistettiin. Mitään varmaa johdonmukaista parantumista potilaiden voinnissa ei havaittu, mutta yksittäisillä potilailla oli PET-tutkimuksessa viitteitä positiivisesta vasteesta. Tämä oli kunnianhimoinen tutkimus, joka vaati paljon sekä tutkijoilta että potilailta. Tietysti olisi toivonut parempia kliinisiä tuloksia, mutta toisaalta nämä tulokset ovat aika lailla samanlaisia kuin mitä muilla hermokasvutekijöillä on jo aiemmin saatu. Herantis Pharma näyttää nyt keskittyvän yhdisteeseen, jolla olisi hermokasvutekijän ominaisuudet, mutta olisi helpompi annostella (https://herantis.com/fi/(siirryt toiseen palveluun)).
Lääketehdas Orionin tutkijat julkaisivat tutkimuksen, jossa selvitettiin karbidopan annoksen nostamisen vaikutusta levodopan plasmatasoihin [15]. Mukana oli 25 tervettä koehenkilöä, jotka saivat korotettua karbidopan annosta (50 tai 100 mg) yhdessä levodopa/karbidopa-tabletin (100/25 mg) kanssa. Osa sai myös entakaponia (200 mg). Karbidopa-annoksen lisäys nosti merkitsevästi levodopan plasmapitoisuuksia, etenkin entakaponia saaneiden ryhmässä. Tutkimus osoittaa, että karbidopan annosta kannattaisi lisätä levodopa- ja levodopa/entakaponi -tableteissa, mutta tämä vaatinee myös uusia potilastutkimuksia, joihin lääketehtailla ei ole ollut toistaiseksi halukkuutta.
Helsinkiläiset neurologit julkaisivat HUS:n neurologian klinikassa hoidettujen levodopa/entakaponi/karbidopa suoli-infuusiota (Lecigon®) saaneiden potilaiden hoitotuloksia [16]*. Lecigon on uudempi suoleen infusoitava levodopavalmiste. Verrattuna aiemmin markkinoille tulleeseen Duodopaan®, Lecigon sisältää myös entakaponia ja sen infuusioon tarvittava pumppu on pienempi kuin Duodopa-valmisteella. Tutkijat ovat hoitaneet 30 Lecigonia saanutta potilasta. Kuuden kuukauden seuranta-aikana seitsemän potilasta keskeytti hoidon johtuen pääasiassa vaikeudesta löytää oikea annostus tai neuropsykiatrisista syistä. Hoidon aikana raportoidut haitat olivat samantapaisia kuin mitä Duodopalla on raportoitu. Potilaat olivat tyytyväisiä pieneen pumppuun, joka lienee selvin tämän uuden valmisteen etu.
Parkinsonin tauti, syväaivostimulaatio (DBS)
Oululaiset neurologit ja neurokirurgit julkaisivat kaksi syväaivostimulaatioon (DBS) liittyvää tutkimusta. Ensimmäisessä tutkimuksessa he selvittivät subtalaamisen tumakkeen yhteyksiä aivojen etulohkon motorisiin alueisin käyttäen magneettikuvia ja niistä tehtyjä ratayhteyksiä (traktografia)[17]. (Subtalaaminen tumake on tavallisin paikka, johon stimulaatioelektrodit asennetaan Parkinsonin tautia sairastavilla.) He tutkivat 22 stimulaatiopotilaan tiedot ja magneettikuvat. Tulosten perusteella he arvioivat, että subtalaamisen tumakkeen sen osan stimulaatio, josta on suora yhteys supplementaarisen liikeaivokuoren etuosaan (presupplementaarinen liikeaivokuori), antaa parhaimman hoidollisen tuloksen.
Toisessa tutkimuksessa he selvittivät 43 parkinsonpotilaan elämänlaatua ennen subtalaamisen tumakkeen stimulaatiohoitoa ja vuosi hoidon jälkeen [18]. He havaitsivat, että DBS-hoito paransi potilaiden elämänlaatua merkittävästi, ja se paransi myös motoriikkaa ja vähensi selvästi lääkityksen tarvetta (kuva 2). Tulokset tukevat aiempia havaintoja, mutta elämänlaadun osalta aiempia tutkimuksia on vähän. Kuvassa 2 on esitetty heidän tutkimuksensa graafisesti.

Kuva 2. Subtalaamisen tumakkeen stimulaation suotuisa vaikutus parkinsonpotilaiden elämänlaatuun. Julkaisusta Kähkölä ym. 2023 [18].
Parkinsonin tauti, genetiikka
Katsausartikkelissa kuvataan 59 eri puolilla maailmaa olevan Parkinsonin taudin tutkimuskeskuksen verkostoituminen [19]. Suomesta mukana on Turun yliopisto prof. Valtteri Kaasisen johdolla. Pyrkimyksenä on yhdistää tietoja erityisesti perinnöllisten Parkinsonin tautimuotojen kohdalla, joissa usein yhden keskuksen potilasmäärät ovat hyvin pieniä. Hienoa, että Turku on jo mukana tässä.
Oululaiset tutkijat kuvaavat kolme nuorena (<50 v.) Parkinsonin tautiin sairastunutta suomalaista potilasta, joilta löytyi RFC1 geenin mutaatio [20]*. Jo aiemmin on tiedetty, että tämän geenin mutaatiot aiheuttavat CANVAS-oireyhtymäksi kuvatun sairauden, johon kuuluu pikkuaivojen rappeutuminen ja sen aiheuttama ataksia, tasapainoelimen rappeutuminen ja ääreishermoston rappeutuminen (neuropatia). Tämä eräs niistä harvoista geenivirheistä, joita suomalaisilta parkinsonpotilailta on löydetty.
Parkinsonin tauti, mikrobit
Vuonna 2023 julkaistiin vain yksi, osin Suomeen liittyvä tutkimus suoliston mikrobien ja Parkinsonin taudin välisistä yhteyksistä. Tämä on selvästi vähemmän kuin parina edeltävänä vuotena. Dos. Filip Scheperjans Helsingin yliopistosta oli mukana kansainvälisessä katsausartikkelissa, jossa käsiteltiin suoliston mikrobien merkitystä Parkinsonin taudin synnyssä [21]. Katsauksessa käytiin läpi asiasta julkaistut tutkimukset ja vedettiin yhteen saatuja tuloksia. Artikkelin tarkempi arviointi vaatii aikamoista bakteriologian tuntemusta, mutta kirjoittajien johtopäätöksenä oli, että voihappoa muodostavat bakteeriryhmät ovat vähentyneet ja limaa hajottavat bakteeriryhmät lisääntyneet parkinsonpotilailla. Lopputuloksena voisi olla lisääntynyt tulehdusreaktio suolen seinämässä.
Parkinsonin tauti, dyskinesiat
Prof. Valtteri Kaasinen Turusta oli mukana kansainvälisessä katsausartikkelissa, jossa arvioitiin kulttuurieroja parkinsonpotilaiden kokemasta pakkoliikkeiden (dyskinesioiden) aiheuttamasta haitasta [22]. Tutkimuksessa käytettiin kansainvälisen liikehäiriöjärjestön (MDS) keräämää dyskinesia-aineistoa. MDS on kehittänyt useampikohtaisen dyskinesian arviointiasteikon, joka on käännetty ainakin 16 eri kielelle. Analyysi osoitti selviä kielialueiden (kansallisuuksien) välisiä eroja siinä, miten haitallisina potilaat pitivät dyskinesioitaan. Kiinaa puhuvat kokivat dyskinesiat haitallisimmiksi, kun taas koreaa puhuvat kokivat ne vähemmän haitallisiksi kuin muut. Suomea puhuvien potilaiden kohdalla tulos oli lähellä keskimääräistä. Tämäkin tutkimus osoittaa, miten kulttuurierot voivat vaikuttaa paljonkin erilaisten kyselytutkimusten tuloksiin.
Parkinsonin tauti, puhe
Dos. Nelly Penttilä Tampereelta työtovereineen julkaisi kaksi parkinsonpotilaiden puhetta analysoivaa tutkimusta. Ensimmäisessä tutkimuksessa mukana oli 31 parkinsonpotilasta ja 36 kontrollihenkilöä, joiden äänitettyä puhetta analysoitiin puoliautomaattisin menetelmin [23]. Tutkijat havaitsivat, että miespuolisten potilaiden puhe (prosodia) erosi kontrolleista. Toisessa tutkimuksessa he testasivat automaattista puheen vokaalien artikuloinnin analysointia ja vertasivat tuloksia kuuntelulla tehtyihin arviointeihin [24]. Arviossa oli mukana 15 parkinsonpotilasta ja 15 kontrollihenkilöä. Tuloksena oli, että automaattinen menetelmä ja vanhempi kuuntelumenetelmä korreloivat ja uusi menetelmä sopinee puheen ymmärrettävyyden arviointiin.
Parkinsonin tauti, älylaitteet
Älypuhelimia ja erilaisia rannekkeita käytetään yhä enemmän myös Parkinsonin taudin oireiden arviointiin. Suomalaisessa monikeskustutkimuksessa oli mukana 42 parkinsonpotilasta ja 23 kontrollihenkilöä, jotka kantoivat älyranneketta (Garmin Vivosmart 4) neljän viikon ajan ja kirjasivat vointiaan ja lääkitystään myös älypuhelinsovelluksella [25]. Tämä tutkimus keskittyy erityisesti rannekkeesta saadun liikeinformaation analysointimenetelmiin. Tutkijoiden loppupäätelmä on, että tarvitaan vielä lisätutkimuksia, jotta tämänkaltaisesta järjestelmästä saataisiin luotettavaa informaatiota.
Parkinsonin tauti, kliininen testi
Yksi tyypillinen Parkinsonin taudin piirre on mikrografia eli kirjainten pienentyminen käsin kirjoittaessa. Pyydettäessä parkinsonpotilasta piirtämään taloa ikkunoineen ja ulko-ovineen, on havaittu, että potilas ei usein pysty piirtämään ovea kiinni lattiaan ja ilmiölle on annettu nimeksi ”kelluvan oven merkki” (kuva 3). Ilmiötä on pidetty tyypillisenä Parkinsonin taudin mikrografian piirteenä. Nyt suomalaiset neurologit halusivat testata, kuinka spesifinen tämä löydös on Parkinsonin taudille [26]. He ottivat tutkimukseen 144 parkinsonpotilasta, 41 essentiaalista vapinaa sairastavaa potilasta ja 38 tervettä kontrollia. Tulos oli positiivinen 47 %:lla parkinsonpotilaista ja 37 %:lla essentiaalista vapinaa sairastavista. Ero ei ollut tilastollisesti merkitsevä. On siis syytä unohtaa tämä testi spesifisenä osoittamaan Parkinsonin tautia.

Kuva 3. Vasemmalla normaali talon piirustus ja oikealla talo, jossa ”kelluva ovi”.
Parkinsonin tauti, itsehoito
Oululaiset tutkijat olivat mukana tutkimuksessa, jossa pyrittiin saamaan tietoa parkinsonpotilaiden itsehoitomenetelmistä [27]. Onhan hyvin tunnettua, että potilaat usein keksivät ja kehittävät menetelmiä, jolla päivittäistä vointia voi helpottaa. Tutkijat kehittivät nettipohjaisen ohjelman, jota testattiin 288 potilaalla ja 31 omaishoitajalla. Ohjelma on julkinen ja kaikkien käytettävissä englanninkielisellä sivustolla (https://PDCareBox.com(siirryt toiseen palveluun)). Suositan tutustumaan ohjelmaan.
Lewyn kappale -tauti
Lewyn kappale -taudista eli muistisairaudesta, johon liittyy mm. parkinsonismia ja näköharhoja, julkaistiin kaksi rekistereihin perustuvaa tutkimusta, joissa helsinkiläiset psykiatrit selvittelivät taudin merkitystä ihmisten kriminaalisessa eli rikoksiin liittyvässä käyttäytymisessä. Muistisairaudet (Alzheimerin tauti, otsa-ohimolohkorappeuma ja Lewyn kappale -tauti) vaikuttavat ihmisen käyttäytymiseen ja siten on mahdollista, että ne lisäisivät myös taipumusta tehdä rikkeitä tai rikoksia. Näin ei kuitenkaan näytä tapahtuvan ainakaan suomalaisilla muistisairailla rekisteritietojen mukaan [28]. Rikosten määrä oli noin puolet vähemmän oletetusta. Eniten rikkeisiin syyllistyivät otsa-ohimolohkorappeumaa ja Lewyn kappale -tautia sairastavat miehet. Toisessa saman ryhmän rekisteritutkimuksessa selviteltiin rikkeistä tai rikoksista tuomittujen muistisairaiden kuolleisuutta [29]. Tutkijat havaitsivat, että Lewyn kappale tautia sairastavilla ja naispuolisilla otsa-ohimolohkorappeumaa sairastavilla oli suurempi kuolleisuus kuin vertailuväestöllä ilman rikostaustaa. Tarkkaa syytä löydökseen ei pystytty rekisteritiedoista päättelemään.
Helsingistä lähtöisin, mutta nyt USA:ssa tutkijana toimiva LT Karri Kaivola oli ensimmäisenä kirjoittajana laajassa tutkimuksessa, jossa selviteltiin Lewyn kappale -taudin ja otsa-ohimolohkorappeuman perinnöllisiä poikkeavuuksia [30]. Tutkijat tekivät koko genomin sekvensoinnin yli 5000 potilastapaukselle ja yli 4000 kontrollihenkilölle. He löysivät yhden uuden deleetion TPCN1-nimisessä geenissä, joka näyttäisi olevan riski Lewyn kappale -taudille. Lisäksi he löysivät uusia variantteja otsa-ohimolohkorappeumaan liittyvissä geeneissä. Pikkuhiljaa geenitieto lisääntyy myös Lewyn kappale -taudissa.
Dos. Jussi Sipilä Joensuusta ja Turusta yhdessä oululaisten kollegoiden kanssa löysivät suomalaisen suvun, jossa glukoserebrosidaasi-geenin virheeseen liittyi nopeasti etenevä Lewyn kappale -tauti [31]*. Entuudestaan tiedetään, että glukoserebrosidaasi-geenin (GBA1) erilaiset variaatiot lisäävät riskiä sairastua Parkinsonin tautiin tai Lewyn kappale-tautiin. He kuvaavat kaksi sisarusta, jotka sairastuvat parkinsonismiin ja joiden neuropatologiset löydökset sopivat Lewyn kappale -tautiin. Molemmilla tavattiin GBA1 geenin heterotsygoottinen variantti (p.Pro454Leu) ja suvussa oli tiedossa muitakin jo menehtyneitä parkinsonpotilaita, joilla on ollut todennäköisesti sama geenivariantti. Löydös on yksi lisäys toistaiseksi aika vähäisiin suomalaisten parkinsonismipotilaiden geenivirheisiin.
Dystonia ja dyskinesia
Prof. Juho Joutsan ryhmä Turusta selvitteli, millaisia aineenvaihdunnallisia muutoksia globus pallidus- tumakkeen eli pallidum -tumakkeen sähköinen stimulaatio aiheuttaa aivoissa [32]. Globus pallidus -tumakkeen syväaivostimulaatiota (DBS) käytetään nykyisin vaikean servikaalisen dystonian hoitona. Ei kuitenkaan oikein tiedetä, mihin hoidon teho perustuu. Tutkimuksessa oli mukana 11 dystoniapotilasta, joille tehtiin aineenvaihduntaa mittaava fluorodeoksiglukoosi-PET-tutkimus kahdesti, ilman stimulaatiota ja stimulaation kanssa. Stimulaatio lisäsi aineenvaihduntaa pallidum- ja putamen-tumakkeissa, subtalaamisessa tumakkeessa sekä primaarisilla tunto- ja liikeaivokuoren alueilla. Dystonian lieveneminen korreloi primaarisen tunto- ja liikeaivokuoren muutoksiin. Tutkimus antaa lisätietoa, mitkä hermoverkot aktivoituvat pallidum-tumakkeen stimulaatiosta.
Prof. Juho Joutsa oli eräänä kirjoittajana laajassa katsausartikkelissa, jossa käytiin läpi dystoniaan liittyviä kuvantamis-, aivovaurio- ja eläintutkimuksia pyrkien selvittämään, mitkä aivoalueet ja hermoverkot ovat osallisena dystonian synnyssä [33]. Tutkijat totesivat, että eri dystonian muodoissa eri aivoalueet ja hermoverkot aktivoituvat. Tärkeimmät dystoniaan liittyvät aivoalueet ovat tyvitumakkeet ja pikkuaivot.
Suomalaiset lastenneurologit ja neurologit kuvasivat 38—vuotiaan miehen, jolla oli mm. älyllistä kehitysvammaisuutta, vapinaa ja dystoniaa ja jolta löytyi geenitutkimuksessa (eksomisekvensointi) ARX-geenin virhe [34]. Tämä geenivirheen tiedetään aiheuttavan Parlingtonin oireyhtymän, joka on X-kromosomaalinen sairaus. Eksomisekvensointi osoitti käyttökelpoisuutensa tällaisessa tapauksessa, jossa oli vuosia yritetty päästä tarkempaan diagnoosiin.
Helsingin yliopiston lasten neurologisia sairauksia selvittelevät tutkijat julkaisivat artikkelin, jossa käsiteltiin geneettisten eli perinnöllisten syiden osuutta etenevissä lastenneurologissa sairauksissa [35]. He tutkivat 48 lasta, joiden taudin syy oli epäselvä. Potilailla oli monenlaisia eteneviä neurologisia oireita; 5:llä (11 %) oli liikehäiriöitä. Tutkimuksena käytettiin koko eksomin sekvensointia. 20 (42 %) lapselta löydettiin poikkeava tautiin liittyvä geenivariantti. Näistä kahdeksalta löydettiin uusi variantti. Yhdeltä liikehäiriöitä sairastavalta (dyskinesia, myokymia) löytyi poikkeava geenivariantti. Tutkijat toteavat koko eksomin sekvensoinnin olevat tehokas keino löytää syyltään tuntemattoman etenevän neurologisen taudin syy.
Ataksia
Monikansallisessa tutkimuksessa, jossa oli mukana oululaisia tutkijoita, selvitettiin erään perinnöllisen pikkuaivosairauden, spinokerebellaariataksia (SCA) 29, liittyvän geenivirheen (ITPR1 geeni) eri variantteja ja niiden aiheuttamia tautimuotoja [36]. Ryhmä löysi 46 potilasta, joilla osalla oli uusia variantteja. Artikkelissa kuvataan, minkälaisia kliinisiä ja kuvantamislöydöksiä potilailla oli.
Norjalaisessa tutkimuksessa, jossa oli mukana tutkijoita Helsingin yliopistosta, selvitettiin nikotiiniamidi (NAD) ribosidin vaikutuksia ataksia telangiektasian oireisiin ihmispotilailla [37]. Nikotiiniamidi eli niasiini eli B3-vitamiini tarvitaan mm. mitokondrioiden toiminnassa. Ataksia telangiektasia on harvinainen periytyvä lapsuudessa alkava sairaus, johon liittyy pikkuaivojen rappeumaa, immunologisia muutoksia ja syöpäalttiutta. Tautiin ei ole käytettävissä mitään spesifistä hoitoa. Tutkimuksessa oli mukana 13 potilasta, joista 10 käytti nikotiiniamidi ribosidia (2×250 mg) 18 kuukauden ajan. Lääke oli hyvin siedetty ja se lisäsi veren NAD-pitoisuutta. Tutkijat havaitsivat motoriikan ja silmän liikkeiden parantumista hoidon aikana. Koska tutkimus oli avoin ja potilasmäärä oli pieni, kovin pitkälle meneviä johtopäätöksi NAD ribosidin tehosta ei voi tehdä. Samaa ainetta tutkitaan paraikaa myös Parkinsonin taudissa.
Vapina
Prof. Juho Joutsa Turusta oli mukana katsausartikkelissa, jossa käytiin läpi essentiaaliseen vapinaan liittyvät magneettitutkimuslöydökset ja pääteltiin niiden perusteella vapinaan liittyviä hermoverkkoja [38]. Ilmeni, että pikkuaivot ovat tärkein ratayhteyksien solmukohta essentiaalisessa vapinassa. Yhteenveto vahvistaa pikkuaivojen toiminnan häiriön tärkeyden essentiaalisen vapinan synnyssä.
Toisessa katsausartikkelissaan prof. Juho Joutsa kollegoineen käsitteli aivokudoksen paikallisten vaurioiden ja vauriointihoitojen eli leesiohoitojen merkitystä liikehäiriösairauksissa [39]. Vuosien mittaan on kertynyt paljon tietoa siitä, millaisia oireita tietyn aivoalueen vaurioon liittyy. Lisäksi vuosikymmeniä on käytetty mm. talamuksen leesiointeja (talamotomioita) kuumentamalla sekä essentiaalisen vapinan että Parkinsonin taudin vapinan hoidossa (kuva 4).

Kuva 4. Aivoalueiden vaurioihin ja vauriointiin (leesiointiin) liittyvää historia. (Timeline of selected events illustrating the role of lesions in neuroscience and medicine.
Parantuneet kuvantamistekniikat ovat tuoneet lisätietoa pientenkin aivovaurioiden yhteydestä liikehäiriöoireisiin ja on saatu tietoa erilaisten hermoverkkojen merkityksestä oireiden synnyssä. Uutena leesiointitekniikkana on tullut kohdennettu ultraäänihoito, joka voidaan tehdä kalloa avaamatta. Talamuksen toispuoleinen vauriointi tällä tekniikalla on hyväksytty essentiaalisen vapinan ja Parkinsonin taudin vapinan hoitoon. USA:ssa myös molemminpuolinen talamuksen ultraäänellä tehty vauriointi on hyväksytty essentiaalisen vapinan hoitoon. Tämä on hyvä katsausartikkeli, joka on avoin, kaikkien luettavissa.
Tiedetään, että pieni määrä alkoholia vähentää käsien vapinaa ja alkoholin käyttö on kielletty mm. ampujilta dopingina. Sen sijaan on arveltu, että pienikin määrä alkoholia veressä heikentää neurokirurgisten toimenpiteiden tekemistä. Nyt suomalaiset neurokirurgit ja neurokirurgiaan erikoistuvat päättivät selvittää asiaa [40]. He olivat itse koe-henkilöinä, nauttivat pieniä määriä alkoholia ja testasivat haavan ompelemiskykyään, ei kuitenkaan potilailla vaan koelaboratoriossa. Kävi ilmi, ettei pieni määrä alkoholia huonontanut ompelemiskykyä; päinvastoin, paras suoritus saatiin 0,44 promillen humalassa! Hekin havaitsivat, että alkoholi vähensi fysiologista vapinaa ja joka selitti saadun tuloksen. Ehkä tulosta ei voida kuitenkaan yleistää käytännön työhön. Pieni tutkimus, jossa todennäköisesti osallistujilla on ollut hauskaa!
Huntingtonin tauti
Dos. Jussi Sipilä Joensuusta ja prof. Kari Majamaa Oulusta selvittivät, onko viimeisen kymmenen vuoden aikana tapahtunut Huntingtonin taudin esiintyvyydessä muutoksia Suomessa [41]*. Ryhmän aiempien tutkimusten perusteella Huntingtonin taudin esiintyvyys Suomessa on selvästi alhaisempaa kuin muualla Länsi-Euroopassa. Huntingtonin taudin esiintyvyydeksi he saivat nyt 2,57/100 000, joka ei eronnut merkittävästi edellisen tutkimuksen tuloksesta, joka päättyi vuoteen 2010.
Wilsonin tauti
Dos. Jussi Sipilä ryhmineen tutki suomalaisten Wilsonin tautia sairastavien geenimuutoksia ja potilaiden oirekuvia [42]. Wilsonin tauti on harvinainen peittyvästi periytyvä aineenvaihduntasairaus, johon liittyy kuparin kertyminen erityisesti aivoihin, silmiin ja maksaan. Sen oireina ovat monenlaiset liikehäiriöt ja maksan toiminnan häiriöt. Mukana oli kuusi homotsygoottista potilasta ja 11 yhdistelmäheterotsygoottista potilasta. Näiden ryhmien välillä ei ollut eroa oirekuvissa, mutta homotsygootit sairastuivat nuorempana. Vakava maksavaurio liittyi tiettyyn geenimuutokseen. Paljon saatiin irti suomalaisesta potilasaineistosta, vaikka tauti on Suomessa hyvinkin harvinainen.
Dos. Fredrik Åberg HUS:sta yhdessä ruotsalaisten kollegoiden kanssa julkaisi Wilsonin taudin kuolleisuutta käsittelevän tutkimuksen [43]. Aineistona oli 151 Ruotsin rekistereistä löytyvää Wilsonin tautia sairastavaa potilasta. Vertailuaineistona oli 1441 tervettä henkilöä. Tuloksena oli, että Wilsonin tautia sairastavilla oli 3,8 kertainen kuolleisuus terveisiin verrattuna. Tulos osoittaa, että edelleen olisi paljon parannettavaa Wilsonin taudin hoidossa, vaikka siihen onkin käytettävissä kuparia sitovia lääkeaineita.
Touretten oireyhtymä
Prof. Juho Joutsa Turusta oli mukana katsausartikkelissa, joka käsitteli Touretten oireyhtymään liittyvien TIC-pakkoliikkeiden taustalla olevia anatomisia alueita ja hermoverkkoja [44]. Ryhmä keräsi julkaisuista TIC-liikkeisiin liittyvät aivovauriokohdat ja niiden perusteella pystyi kartoittamaan tietokonepohjaisilla ohjelmillaan tärkeimmät aivojen hermoverkot. Ilmeni, että TIC-liikkeisiin liittyviä vauriokohtia oli useissa eri aivojen paikoissa, mutta tärkeimmät kohdat olivat tyvitumakkeiden alueilla. Yhteydet tyvitumakkeista etuaivoihin ja aivovyön (cingulum) alueille vaikuttavat toimivan epänormaalisti Touretten oireyhtymässä. Tutkimus antaa paljon lisätietoa Touretten oireyhtymään liittyvistä anatomisista poikkeavuuksista. Tämä tutkimus on yksi lisä prof. Juho Joutsan korkeatasoisiin hermoverkkotutkimuksiin (brain mapping).
Turkulaiset puheterapian ja lastenpsykiatrian asiantuntijat kuvasivat kaksi poikaa, joilla on Touretten oireyhtymään liittyvä puheen vaikeus, joka muistuttaa änkytystä [45]. He pystyivät helpottamaan potilaiden puhetta käyttämällä änkytyksen hoitoon kehitettyä puheterapiaa.
Neuroepidemiologia
Julkaisussaan dos. Jussi Sipilä kävi läpi neurologisten tautien epidemiologiaa Suomessa perustuen käytettävissä oleviin tietoihin [46]. Kirjoittaja kuvasi, miten tietyt neurologiset sairaudet ovat tavallisempia Suomessa kuin muualla. Tähän ryhmään kuuluvat ns. suomalaisen tautiperinnön sairaudet, mutta myös etenevä myoklonusepilepsia (Unverricht-Lundborgin tauti), multippeli skleroosi (MS), amyotrofinen lateraaliskleroosi (ALS), spinaalinen lihasatrofia (Jokela-tyyppi) ja aikuisiän dystoniat. Toisaalta eräät sairaudet ovat harvinaisempia Suomessa kuin muualla, esimerkkinä Friedreichin ataksia ja Wilsonin tauti. Monesta tavallisesta neurologisesta sairaudesta, kuten migreenistä, Alzheimerin taudista tai Parkinsonin taudista käytettävissä olevat tiedot ovat jonkin verran epävarmoja (kuva 5). Lopuksi kirjoittaja toi esiin, miten lainsäädölliset määräykset (mm. ns. toisiolaki) ja datan keräämisen hinnoittelut ovat vaikeuttaneet huomattavasti epidemiologisen tutkimisen tekemistä Suomessa. Artikkeli on hyvä yhteenveto suomalaisesta neuroepidemiologiasta.
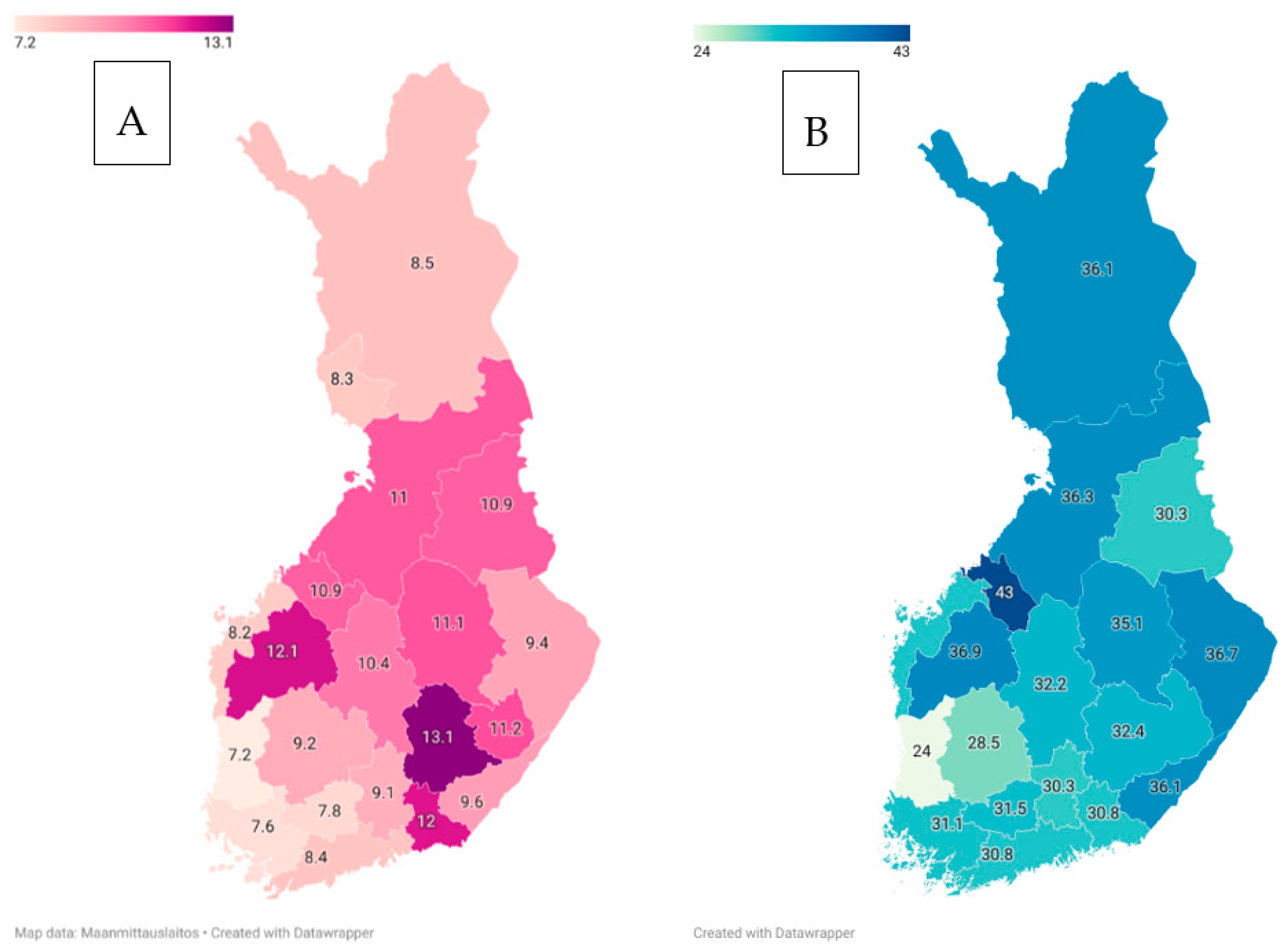
Kuva 5. Alzheimerin taudin (A) ja parkinsonismin (B) ilmaantuvuus Suomessa.
Hemifasiaalispasmi
Hemifasiaalispasmi on toispuoleinen kasvojen alueen lihasnykäys, jonka taustalla on kasvohermon toiminnan häiriö. Tavallisimmin syynä on verisuonen aiheuttama ajoittainen kasvohermon puristustila aivorungon alueella. Sen hoitoon voidaan käyttää botuliinia tai joskus verisuonikirurgista hoitoa. Se on olemukseltaan liikehäiriö, vaikka ei sitä varsinaisesti lueta liikehäiriösairauksiin.
Helsinkiläiset neurologit ja neurokirurgit ovat nyt selvittäneet, kuinka tavallinen tauti hemifasiaalispasmi on Suomessa [47]. He kävivät läpi vuosina 2014-2019 HUS:n alueella hoidetut potilaat. He löysivät 279 potilasta, joista 62 % oli naisia ja 62 %:lla oireet olivat vasemmalla puolen. Miehillä oireet alkoivat tavallisimmin yli 60-vuotiaana ja naisilla yli 80-vuotiaana. Vuotuiseksi ilmaantuvuudeksi saatiin 1,53/100 000 ja esiintyvyydeksi 10,62/100 000. Hyvä suomalainen tutkimus aiheesta, josta on maailmanlaajuisestikin vähän tietoa.
Artikkelissa on *:llä merkitty tutkimukset, joita Suomen Parkinson-säätiö on tukenut.
Kirjoittaja on Seppo Kaakkola, prof.(h.c.), neurologian ja kliinisen farmakologian erikoislääkäri
Kirjallisuusviitteet
1. Paakinaho A, Tiihonen M, Koskela H et al. beta2-Adrenoceptor Agonists in Asthma or Chronic Obstructive Pulmonary Disease and Risk of Parkinson’s Disease: Nested Case-Control Study. Clin Epidemiol, 2023. 15: 695-705. https://doi.org/10.2147/CLEP.S405325
2. Pirttila A, Tiihonen M, Paakinaho A et al. Hospitalization and the Risk of Initiation of Antipsychotics in Persons With Parkinson’s Disease. J Am Med Dir Assoc, 2023. 24(9): 1290-1296 e4. https://doi.org/10.1016/j.jamda.2023.04.004
3. Babar BA, Kettunen R, Tiihonen M et al. Prevalence of cardiovascular drugs and oral anticoagulants use among persons with and without Parkinson’s disease. Cardiology, 2023. https://doi.org/10.1159/000535691
4. Ilmaniemi S, Tolppanen AM, Herukka SK et al. Incidence and outcomes of head injuries in people with and without Parkinson disease. Eur J Neurol, 2023. 30(6): 1648-1657. https://doi.org/10.1111/ene.15782
5. Rumrich IK, Lin J, Korhonen A et al. Long-term exposure to low-level particulate air pollution and Parkinson’s disease diagnosis – A Finnish register-based study. Environ Res, 2023. 229: 115944. https://doi.org/10.1016/j.envres.2023.115944
6. Sallmen M, Burstyn I, Uuksulainen S et al. Parkinson’s disease and occupational exposure to organic solvents in Finland: a nationwide case-control study. Scand J Work Environ Health, 2023. https://doi.org/10.5271/sjweh.4125
7. Sipilä JOT, Kaasinen V, Rautava P et al. Case-Fatality Rate in Parkinson’s Disease: A Nationwide Registry Study. Mov Disord Clin Pract, 2023. https://doi.org/10.1002/mdc3.13948
8. Backman EA, Luntamo L, Parkkola R et al. Early cortical atrophy is related to depression in patients with neuropathologically confirmed Parkinson’s disease. J Neurol Sci, 2023. 455: 122804. https://doi.org/10.1016/j.jns.2023.122804
9. Waggan I, Rissanen E, Tuisku J et al. Adenosine A(2A) receptor availability in cerebral gray and white matter of patients with Parkinson’s disease. Parkinsonism Relat Disord, 2023. 113: 105766. https://doi.org/10.1016/j.parkreldis.2023.105766
10. Waggan I, Rissanen E, Tuisku J et al. Adenosine A(2A) receptor availability in patients with early- and moderate-stage Parkinson’s disease. J Neurol, 2023. 270(1): 300-310. https://doi.org/10.1007/s00415-022-11342-1
11. Murtomäki K, Joutsa J, Mertsalmi T et al. Dopamine transporter binding in the brain is linked to irritable bowel syndrome in Parkinson’s disease. Brain Behav, 2023. 13(7): e3097. https://doi.org/10.1002/brb3.3097
12. Ellis EG, Joutsa J, Morrison-Ham J et al. Large-scale activation likelihood estimation meta-analysis of parkinsonian disorders. Brain Commun, 2023. 5(3): fcad172. https://doi.org/10.1093/braincomms/fcad172
13. Suuronen I, Airola A, Pahikkala T et al. Budget-Based Classification of Parkinson’s Disease From Resting State EEG. IEEE J Biomed Health Inform, 2023. 27(8): 3740-3747. https://doi.org/10.1109/JBHI.2023.3235040
14. Huttunen HJ, Booms S, Sjogren M et al. Intraputamenal Cerebral Dopamine Neurotrophic Factor in Parkinson’s Disease: A Randomized, Double-Blind, Multicenter Phase 1 Trial. Mov Disord, 2023. 38(7): 1209-1222. https://doi.org/10.1002/mds.29426
15. Tuunainen J, Sjöstedt N, Vahteristo M et al. Effect of Carbidopa Dose on Levodopa Pharmacokinetics With and Without Catechol-O-Methyltransferase Inhibition in Healthy Subjects. Eur J Drug Metab Pharmacokinet, 2023. 48(1): 23-34. https://doi.org/10.1007/s13318-022-00800-w
16. Viljaharju V, Mertsalmi T, Pauls KAM et al. Levodopa-Entacapone-Carbidopa Intestinal Gel Treatment in Advanced Parkinson’s Disease: A Single-Center Study of 30 Patients. Mov Disord Clin Pract, 2023. https://doi.org/10.1002/mdc3.13926
17. Kähkölä J, Lahtinen M, Keinänen T et al. Stimulation of the Presupplementary Motor Area Cluster of the Subthalamic Nucleus Predicts More Consistent Clinical Outcomes. Neurosurgery, 2023. 92(5): 1058-1065. https://doi.org/10.1227/neu.0000000000002292
18. Kähkölä J, Katisko J, Lahtinen M. Deep Brain Stimulation of Subthalamic Nucleus Improves Quality of Life in General and Mental Health Domains in Parkinson’s Disease to the Level of the General Population. Neuromodulation, 2023. https://doi.org/10.1016/j.neurom.2023.03.007
19. Vollstedt EJ, Madoev H, Aasly A et al. Establishing an online resource to facilitate global collaboration and inclusion of underrepresented populations: Experience from the MJFF Global Genetic Parkinson’s Disease Project. PLoS One, 2023. 18(10): e0292180. https://doi.org/10.1371/journal.pone.0292180
20. Ylikotila P, Sipila J, Alapirtti T et al. Association of biallelic RFC1 expansion with early-onset Parkinson’s disease. Eur J Neurol, 2023. 30(5): 1256-1261. https://doi.org/10.1111/ene.15717
21. Kleine Bardenhorst S, Cereda E, Severgnini M et al. Gut microbiota dysbiosis in Parkinson disease: A systematic review and pooled analysis. Eur J Neurol, 2023. 30(11): 3581-3594. https://doi.org/10.1111/ene.15671
22. Kaasinen V, Luo S, Martinez-Martin P et al. Cross-Cultural Differences in Patient Perceptions of Dyskinesia in Parkinson’s Disease. Mov Disord, 2023. 38(4): 688-692. https://doi.org/10.1002/mds.29335
23. Tavi L, Penttilä N. Functional data analysis of prosodic prominence in Parkinson’s disease: a pilot study. Clin Linguist Phon, 2023: 1-18. https://doi.org/10.1080/02699206.2022.2158372
24. Convey RB, Ihalainen T, Liu Y et al. A comparative study of automatic vowel articulation index and auditory-perceptual assessments of speech intelligibility in Parkinson’s disease. Int J Speech Lang Pathol, 2023: 1-11. https://doi.org/10.1080/17549507.2023.2251725
25. Liikkanen S, Sinkkonen J, Suorsa J et al. Feasibility and patient acceptability of a commercially available wearable and a smart phone application in identification of motor states in parkinson’s disease. PLOS Digit Health, 2023. 2(4): e0000225. https://doi.org/10.1371/journal.pdig.0000225
26. Räty V, Eklund M, Nuuttila S et al. Floating door sign does not differentiate Parkinson’s disease from essential tremor. Clin Park Relat Disord, 2023. 8: 100184. https://doi.org/10.1016/j.prdoa.2023.100184
27. Kuosmanen E, Huusko E, van Berkel N et al. Exploring crowdsourced self-care techniques: A study on Parkinson’s disease. Int J Human-Computer Studies, 2023. 177: 103062. https://doi.org/10.1016/j.ijhcs.2023.103062
28. Ginters M, Talaslahti T, Palm A et al. Criminal Behaviour After Diagnosis of a Neurocognitive Disorder: A Nationwide Finnish Register Study. Am J Geriatr Psychiatry, 2023. 31(8): 598-606. https://doi.org/10.1016/j.jagp.2023.01.025
29. Talaslahti T, Ginters M, Kautiainen H et al. Crime, mortality and neurocognitive disorders: A nationwide register study in Finland. Int J Methods Psychiatr Res, 2023. 32(2): e1948. https://doi.org/10.1002/mpr.1948
30. Kaivola K, Chia R, Ding J et al. Genome-wide structural variant analysis identifies risk loci for non-Alzheimer’s dementias. Cell Genom, 2023. 3(6): 100316. https://doi.org/10.1016/j.xgen.2023.100316
31. Sipilä JOT, Kytövuori L, Rauramaa T et al. A severe neurodegenerative disease with Lewy bodies and a mutation in the glucocerebrosidase gene. NPJ Parkinsons Dis, 2023. 9(1): 53. https://doi.org/10.1038/s41531-023-00501-4
32. Honkanen EA, Ronka J, Pekkonen E et al. GPi-DBS-induced brain metabolic activation in cervical dystonia. J Neurol Neurosurg Psychiatry, 2023. https://doi.org/10.1136/jnnp-2023-331668
33. Corp DT, Morrison-Ham J, Jinnah HA et al. The functional anatomy of dystonia: Recent developments. Int Rev Neurobiol, 2023. 169: 105-136. https://doi.org/10.1016/bs.irn.2023.04.004
34. Arvio M, Lahdetie J, Koivu H et al. Manifestations of Intellectual Disability, Dystonia, and Parkinson’s Disease in an Adult Patient with ARX Gene Mutation c.558_560dup p.(Pro187dup). Case Rep Genet, 2023. 2023: 3636748. https://doi.org/10.1155/2023/3636748
35. Aaltio J, Etula A, Ojanen S et al. Genetic etiology of progressive pediatric neurological disorders. Pediatr Res, 2023. https://doi.org/10.1038/s41390-023-02767-z
36. Tolonen JP, Parolin Schnekenberg R, McGowan S et al. Detailed Analysis of ITPR1 Missense Variants Guides Diagnostics and Therapeutic Design. Mov Disord, 2023. https://doi.org/10.1002/mds.29651
37. Presterud R, Deng WH, Wennerstrom AB et al. Long-Term Nicotinamide Riboside Use Improves Coordination and Eye Movements in Ataxia Telangiectasia. Mov Disord, 2023. https://doi.org/10.1002/mds.29645
38. Younger E, Ellis EG, Parsons N et al. Mapping Essential Tremor to a Common Brain Network Using Functional Connectivity Analysis. Neurology, 2023. 101(15): e1483-e1494. https://doi.org/10.1212/WNL.0000000000207701
39. Joutsa J, Lipsman N, Horn A et al. The return of the lesion for localization and therapy. Brain, 2023. 146(8): 3146-3155. https://doi.org/10.1093/brain/awad123
40. Vasankari V, Eisenring C, Rossmann T et al. Small amount of alcohol did not deteriorate microsurgical dexterity: a prospective laboratory study. Acta Neurochir (Wien), 2023. 165(3): 577-583. https://doi.org/10.1007/s00701-023-05501-0
41. Sipila JOT, Majamaa K. Stable low prevalence of Huntington’s disease in Finland. Clin Park Relat Disord, 2023. 8: 100198. https://doi.org/10.1016/j.prdoa.2023.100198
42. Sipilä JOT, Kytövuori L, Kaasinen V. Clinical spectrum and genotype-phenotype associations in Finnish patients with Wilson’s disease. J Neurol Sci, 2023. 448: 120620. https://doi.org/10.1016/j.jns.2023.120620
43. Aberg F, Shang Y, Strandberg R et al. Four-fold increased mortality rate in patients with Wilson’s disease: A population-based cohort study of 151 patients. United European Gastroenterol J, 2023. 11(9): 852-860. https://doi.org/10.1002/ueg2.12452
44. Zouki JJ, Ellis EG, Morrison-Ham J et al. Mapping a network for tics in Tourette syndrome using causal lesions and structural alterations. Brain Commun, 2023. 5(3): fcad105. https://doi.org/10.1093/braincomms/fcad105
45. Peltokorpi S, Laiho A, Carlson V et al. Effectiveness of speech therapy in treating vocal blocking tics in children with Tourette syndrome: Two case reports. Clin Child Psychol Psychiatry, 2024. 29(1): 301-311. https://doi.org/10.1177/13591045231177433
46. Sipilä JOT. Adult-Onset Neuroepidemiology in Finland: Lessons to Learn and Work to Do. J Clin Med, 2023. 12(12). https://doi.org/10.3390/jcm12123972
47. Nurminen P, Marjamaa J, Niemelä M et al. Incidence and prevalence of Hemifacial Spasm in Finland’s largest hospital district. J Neurol Sci, 2023. 446: 120587. https://doi.org/10.1016/j.jns.2023.120587