Suomalaisia liikehäiriöiden prekliinisiä tutkimuksia vuonna 2023
Vuonna 2023 ilmestyi 20 prekliinistä tutkimusta, joissa mukana oli suomalaisia tutkijoita. Näiden tutkimusten määrä vastaa aikaisempia vuosia, eikä määrän kasvua ole havaittavissa.
Tutkimusaiheista yleisin liittyi edelleen hermokasvutekijöihin (GDNF, MANF, CDNF; 8 artikkelia). Alfasynukleiinia (aSyn) käsitteli 4 tutkimusta ja lisäksi useissa kasvutekijätutkimuksissa kohteena oli myös aSyn, joka epäilemättä onkin parkinsontutkimuksen keskeinen aihe. Aivan uusia avauksia ei ollut, mutta uudentyyppistä lähestymistapaa ja uusia tutkimuskeskuksia oli. Helsingin yliopiston merkitys oli edelleen ylivertainen. Aalto-yliopisto esiintyi myös ja tekniset alat olivat edustettuina.
Hermokasvutekijät
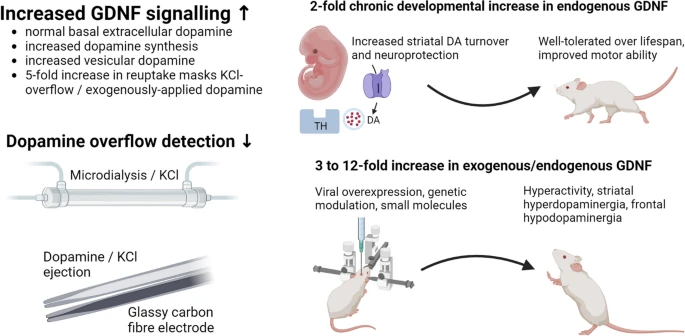
Kahdessa tutkimuksessa pohdittiin GDNF:n optimaalista pitoisuutta aivoissa ja toisaalta suurten GDNF-pitoisuuksien ongelmia. Olfat ym. (1) käyttivät ns. ehdollisia GDNF-hypermorfisia hiiriä, joilla GDNF voidaan nostaa kaksinkertaiseksi. Yllättäen havaittiin, ettei tällainen pitoisuus suojannut lainkaan hiiriä laktokystiinimallissa PD:n kaltaisilta oireilta. Tutkittiin myös miten GDNF:n ilmenemisen estäminen vaikuttaa: ei mitenkään. Johtopäätös on se, ettei endogeenisen GDNF:n modifiointi vaikuta ainakaan laktokysteiinin aivotoksisuuteen.
Marshall (2) katsauksessaan päätyi siihen, että ulkoisesti annettuna tai endogeenisesti kohotettuna n. kaksinkertainen GDNH:n pitoisuus aivoissa on optimaalinen toimimaan suojaavasti PD-malleissa, lisäämään sopivasti dopamiinitoimintaa ja olevan suotuisa liikeoireisiin, ilman liiallista dopamiiniaktiivisuutta. Laktokystiiniä vastaan tämä ei ilmeisesti päde (ks. yllä). Laajassa katsauksessa käytiin läpi myös soluviljelykokeita ja erilaisia eläinkokeita, joissa GDNF:n pitoisuutta oli kohotettu 3 – 12-kertaiseksi. Seurauksena oli dopaminergisiä ylilyöntejä ja eläimillä vakavia liikehäiriöitä. Kohtuus on siis parasta tässäkin asiassa.
Kuva 1. Finding an Optimal Level of GDNF Overexpression: Insights from Dopamine Cycling
Er ja Airavaara (3) selittävät katsauksessaan, miten GDNF ja CDNF vähentävät aSyn-sakkautumista erilaisilla mekanismeilla. Onhan näillä kahdella hermokasvutekijällä muutenkin erilaiset rakenteet ja vaikutusmekanismit suojavaikutuksilleen. Rakenteet on esitetty alla.
Kuva 2. Rakenteet CDNF, GDNF


Sec. Aging Psychiatry
Volume 14 – 2023

Kuten oheista kaavakuvastakin ilmenee, GDNF:llä on yksi vaikutuskohta: se sitoutuu solukalvon Ret-reseptoriin ja kaikki vaikutukset välittyvät erilaisten solunsisäisten signaalireittien kautta. CDNF on piirretty kaaviossa useaan kohtaan ja sillä on ainakin 3 vaikutustapaa: 1) se estää fibrillien pääsyä solun sisään (internalisaatio), 2) CDNF sitoutuu suoraan aSyn:iin ja estää sen kahdentumista (dimerisaatio) ja 3) CDNF vaikuttaa myös solunsisäisiin verkostoihin, jolloin aSyn:n sakkautuminen häiriintyy. Oli mekanismi mikä hyvänsä, hermokasvutekijöiden vaikutus aSyn-aggregaatioon on kummallakin hyödyllinen lisämekanismi PD:n hoitoa ajatellen.
Voutilaisen ryhmä on tutkinut aSyn-fibrillimallin ja 6-OHDA:n yhteisvaikutuksia sekä hiiren keskiaivosoluilla (4) että hiirikokeissa (5). Soluviljelmissä fibrilleillä yksinään ei saatu suurillakaan määrillä dopamiinisolujen tuhoa, 6-OHDA toimi kyllä. Kombinaatiolla ei ylitetty 6-OHDA:n toksista vaikutusta. CDNF ei vaikuttanut kombinaation toksisuuteen, mutta pieni suojavaikutus oli pelkkään 6-OHDA:aan. Hiirimallissa etukäteen valmistettuja fibrillejä annettiin 2 viikkoa ennen 6-OHDA:aa, josta testattiin 3 annosta yhdelle puolelle s. nigran lähelle, ja 2 µg/annos oli optimaalisin. Hiiret testattiin 14 viikon kohdalla. Kombinaatiomyrkyillä saatiin merkittävä dopamiinivaurio, ja vanhat hiiret (2-4 kk) olivat herkempiä kuin nuoret (7-9 viikkoa). CDNF-infuusio striatumiin lievensi pelkän 6-OHDA:n toksisuutta, mutta fibrilli + 6-OHDA-ryhmään ei saatu vaikutusta. Näytti siltä, että 6-OHDA:n toksisuus oli suurempi silloin kun sakkaumat olivat suuria. Hoitokokeilun tulos ei ole kovin rohkaiseva, mutta toisaalta kombinaation toksisuus voi olla ylenpalttinen ja vaikeasta hoidettava.
Huttusen ryhmä (6) raportoi uudesta CDNF:stä (koko 18 kDa) johdetusta peptidomimeetistä (HER-096; koko n. 1 kDa, rakenne ohessa), joka imeytyy ihon alle annettaessa ja kulkeutuu aivoihin kohtuullisesti. Aineen farmakokinetiikka on vaatimaton. T1/2 on n. 30 min, aivoissa ehkä pitempi. Useissa erilaisissa kokeissa in vitro HER-096 toimii yhtä hyvin kuin CDNF tai GDNF: suojaa dopamiinisoluja, estää aSyn-sakkautumista ja modifioi UPR-responssia (laskostumaton proteiini responssi, joka liittyy solunsisäiseen toksiseen hapetusstressiin). Kun yhdistettä annostellaan ihon alle kolmasti päivässä (10 mg/kg), se toimii odotetusti myös iäkkäissä aSyn-fibrillimallin hiirissä, joiden suoriutumista sauvalla tasapainoilussa saadaan parannettua. Varsinaisia PD:n muita peruskokeita ei ainakaan raportoida. Herantis on aloittanut HER-096:lla kliiniset kokeet (faasi 1).
Kuva 3. HER-096 rakenteesta


HER-096 is a CDNF-derived brain-penetrating peptidomimetic that protects dopaminergic neurons in a mouse synucleinopathy model of Parkinson’s disease, https://doi.org/10.1016/j.chembiol.2023.11.005(avautuu uuteen ikkunaan, siirryt toiseen palveluun)
Pakarinen ja Lindholm (7) tarkastelevat katsauksessaan CDNF:n ja MANF:in potentiaalia PD:n hoidossa runsaasti raportoitujen solukokeiden ja eläinkokeiden valossa. Laajaan kirjoitukseen on koottu taulukkoihin likipitäen kaikki viime 10 vuotena julkaistut havainnot. On erinomaista, että myös valtavirrasta poikkeavia havaintoja on käsitelty. Eläinlajien ja solulinjojen välillä on eroja, joita ei ole helppo selittää. Kasvutekijät eivät toimi kaikissa malleissa. Vielä on aukkoja tiedoissa.
Kirjoittajat ovat myös selittäneet ym. hermokasvutekijöiden vaikutusmekanismeja, joista on jo edellä (3) käsitelty. Potilaskokeita ei ole käsitelty. Ratkaisu on hyvä, sillä vaatimattomat hoitotulokset eivät anna aihetta suureen optimismiin.
Voutilaisen ryhmä on tutkinut CDNF:n vaikutusta Huntingtonin taudin transgeenisessä hiirimallissa (N171-82Q; 8). Tässä mallissa on 82 glutamiinitoistoa huntingtiinin pätkässä ja se lienee yksi parhaista tarkoitukseensa, ainakin parempi kuin kinoliinimalli. CDNF-proteiinia (3 µg/24 h) infusoitiin Alzet-minipumpuilla 4 viikon ajan striatumiin. Hiiret olivat 11-viikkoisa kokeen alkaessa ja ne lopetettiin viikoilla 15 tai 16. CDNF-infuusio ei vähentänyt saostumia, mutta liikeoireiden alkaminen viivästyi jonkin verran. Hiukan yllättäen striatumissa nousi BDGF:n (aivoperäinen kasvutekijä) pitoisuus. Aggregaatteja analysoitiin tekoälyyn perustuvalla suomalaisella menetelmällä (deep learning neural network Aiforia), mikä sinänsä on saavutus.
Saarman ryhmällä (Kovaleva ym. 9) on uusia ajatuksia MANF:n toiminnasta. MANF sijaitsee solunsisäisessä endoplasmissa verkostossa, jossa se suojaa hermosoluja hapetusvauriolta. Nyt osoitettiin, että MANF vaikuttaa suoraan UPR-vastetta välittävään sensoriin nimeltä IRE1⍺ eli tämä proteiini toimii MANF:in reseptorina. UPR eli laskostumattomien proteiinien reaktio, jossa endoplastinen verkosto toimii toksisen oksidatiivisen stressin välittäjänä. Verkostossa on proteiini BiP, joka mielellään liittyy IRE1⍺:aan, ja MANF kilpailee tästä sitoumisesta. Kun MANF voittaa, monia edullisia reaktioita aktivoidaan ja solukuolemalta vältytään. Tutkimussarjassa tehtiin paitsi runsaasti sitoutumiskokeita myös lukuisa MANF:n mutaatioita, joilla haarukoitiin MANF:n ja IRE1⍺:n sitoutumisen spesifisyys ja edellytykset. Havainnot varmistettiin vielä 6-OHDA-kokeilla PD rottamallissa.
Kuva 4. MANF-toiminta

Alfasynukleiiniin (aSyn) liittyviä tutkimuksia
Hermokasvutekijöiden vaikutuksia aSyn:iin on kuvattu jo edellä, mutta muitakin näkökulmia on tutkittu.
Cui ym. (10) selvitti suoli-aivo-akselin toimintaa rotan 6-OHDA-mallissa. Suolen läpäisevyyttä ja aSyn-määrää selvittiin 5 viikkoa toksiinin annon jälkeen. Paksusuolen, ohutsuolen ja leesiopuolen aivojen aSyn ja fosforyloitunut aSyn lisääntyivät. Myös ileumin ja colonin tietyt proteiinit nousivat suolen läpäisevyyden merkiksi. Johtopäätös on se, että suoli-aivo-akselin toiminta on kaksisuuntaista ja prosessi voi alkaa myös aivoista ja edetä suolistoon. N. vagus on siinä liikenteessä on avainasemassa kuten on jo kauan tiedetty.
Kilpeläinen ym. (11) kehitti ei-peptidirakenteisia PREP-estäjiä, joista yhtä (HUP-55) tutkittiin aSyn-fibrilli- (virusvektorin avulla aivoihin) ja aSyn-transgeenisissä hiirimalleissa. Kuten aiemmillakin PREP-ligandeilla, uusi yhdiste paransi heikentynyttä motoriikkaa ja alensi aSyn oligomeerien pitoisuuksia striatumissa ja s. nigrassa. Kyse on synteettis-kemiallisesta julkaisusta ja yhdisteet on patentoitu.
Åbo Akademin tutkija (Marimuthu) oli mukana uzbekistanilaisessa ryhmässä kun selvitettiin kuinka sähkökentät vaikuttavat aSyn-säikeiden syntyyn (12). Haluttiin nähdä, voidaanko säikeiden muodostumista estää tai muuntaa ulkoisen kentän avulla. Kokeet tehtiin molekyylidynaamisella simulaatiolla, ja oli todella mahdollista muuttaa fibrillien konformaatiota. Fibrillien hydrofobinen ydin näyttää avautuvan. Täsmällinen sähkökentän voimakkuuskin voitiin määrittää. Käytännön sovellukset eivät ehkä ole kaukana, sillä parametrit ovat aika lähellä niitä, joita käytetään syväaivostimulaatiossa (DBS). Tosin ei ole tiedossa miten klassinen DBS vaikuttaa fibrilleihin. Itse asiassa ei edes tiedetä, onko sähkökentän fibrillivaikutus hyväksi vai pahaksi.
aSyn-sakkautumien merkitystä hiirien käyttäytymiseen on tutkittu hiukan uudelta kantilta. Alwani ym. (13) ruiskuttivat aSyn-fibrillejä molempiin striatumeihin ja mittasivat 3 kk kuluttua hiirien käytöstä ja reaktioita pitkäkestoiseen sosiaaliseen stressiin. Hiirien aktiivisuus avokentässä lisääntyi, ahdistus väheni pimeä-valo-laatikossa ja aktiivinen liikehdintä tail-suspension-testissä (mittaa masennusta). Toisin sanoen, pelkkien aSyn-säikeiden ruiskutus tuntui parantavan hiirien yleistä kognitiivista hyvinvointia. Stressiherkkyys ei muuttunut lainkaan. Eniten aggregaatteja ilmaantui amygdalaan, etuaivokuorelle ja s. nigraan, vähiten 5-HT- ja noradrenaliinihermojen lähtötumakkeisiin (raphe, locus coeruleus). Näyttää siis yllättävästi siltä, että aSyn-sakkaumilla on dopaminergisen haitan ohella kompensatorinen vaikutus kognitiivisiin toimintoihin. Havainto panee miettimään yhä yleistyvän PD-fibrillimallin eri puolia.
aSyn-sakkaumien taustaa on tutkittu myös bakteriologisen etiologian kautta. Valtavirrasta poiketen, Huynh ym. (14), keräsi PD-potilaiden ja heidän terveiden puolisoittensa ulostenäytteitä ja eristi desulfovibrio-kannan bakteerit. On jo hiukan näyttöä siitä, että juuri tämä kanta voisi olla PD:n kannalta merkittävä. Eristettyjä bakteereita PD-potilaista ja terveistä kontrolleista käytettiin sukkulamatojen (C. elegans) ravintona. Vertailussa oli mukana myös pari E. coli kantaa, joilla oli erilainen kyky tuottaa sakkaumia. PD-potilaiden bakteerit aiheuttivat 4 päivän kuluessa merkittävästi enemmän ja suurempia sakkaumia kuin kontrolleilta eristetyt bakteerit. Edellisen ryhmän madot myös kuolivat nopeammin. Tämä tutkimus tukee nimenomaan sitä, että suolistobakteerien joukossa nimenomaan desulfovibriot ovat keskeisiä aSyn-aggregaation aiheuttajia ja ehkä merkityksellisiä PD:n synnyssä. Nyt on vasta tutkittu sukkulamatoja, joten korkeamman tason eläinkokeita odotetaan mielenkiinnolla.
Sukkulamatoja käytettiin myös Gomez-Escribauon ym. (15) tutkimuksessa, jossa espanjalaisten tutkijoiden joukossa oli Suomessa toimiva Mora-Martinez. He seuloivat C. elegansin mutaatioita, jotka erityisesti aiheuttaisivat proteiinisakkaumia. Löytyi mm. eräs mutaatio, stomatiinin homologi, UNC-1. Se lisäsi monimutkaisten vaiheiden jälkeen polyglutamiinin toistojaksoja (polyQ). Toinen tumareseptori, DAF-12, toimi vastavaikuttajana. Jatkotutkimuksissa UNC-1:n todettiin liittyvän sulfotransferaasiin ja rasvojen metaboliaan. Johtopäätöksenä on, että joukko rasvametabolian entsyymejä voisi toimia kohteina etsittäessä uusia lääkeaineita aivojen rappeumasairauksiin.
Muita prekliinisiä tutkimuksia
Lehtosen/Koistinahon ryhmä on jatkanut kantasoluihin perustuvaa tutkimustaan (Ohtonen ym. 16). Pluripotentteja kantasoluja tuotettiin mikrogliasoluista (iMGLs). Nyt iMGLs:iin on tehty myös LRRK2-mutaatio PD:n merkiksi. Näitä soluja on verrattu PD-potilaista eristettyihin mikroglioihin ja merkittäviä yhtäläisyyksiä havaittiin. Suosittelevat nyt näitä soluja käytettävän hyväksi kun tutkitaan mikroglian merkitystä PD:n synnyssä. Kannattaa todeta, että tämä raportti lienee osa ns. minibrain-ajattelua, jossa aivoja voitaisiin mallittaa kantasoluista kehitetyillä solumalleilla.
Lähinnä venäläisistä koostuva ryhmä (17), mukana Oulusta työskentelevä Igor Meglinski, on käsitellyt laajassa katsauksessaan ns. lämpöshokkiproteiineja, erityisesti Hsp70 ja Hsp90 hermo-rappeumasairauksissa. Hsp70 näyttäisi olevan suojaava tekijä. Sen määrää voidaan lisätä muutamilla tunnetuilla lääkeaineilla (rilutsoli, pioglitatsoni, kolkisiini) tai geeninsiirroilla. Katsaus on perinpohjainen ja sisältää laajoja taulukoita. Todellisia hoitoja tai muita keinoja vaikuttaa näihin proteiineihin ei oikeastaan vielä ole. Kliiniset esimerkit ovat todistusvoimaltaan heikkoja. Ollaan teoriatasolla.
N. 100 tutkijan artikkeli (18), jossa mukana tutkijoita Kuopiosta, käsittelee tietyn HLA (human leucocyte antigen), HLA-DRB1*04, suojaavaa vaikutusta mm. PD:ssa. Osa näistä proteiineista sitoo Tau-proteiinia. Taun palanen (PHF6) osallistuu sakkauman muodostamiseen, jos se on asetyloitunut (siis a-PHF6). Ajatuksena näyttäisi olevan rokottaa a-PHF6:lla, jolloin sakkautuminen jäisi tapahtumatta. Jäämme seuraamaan tilanteen kehittymistä.
Aalto Yliopiston tutkijat ovat mukana harvinaisessa mikro-RNA-katsauksessa (Negi, Kesaris; 19). Taustalla on monien yleisanestesia-aineiden aiheuttama hermotoksisuus, joka voidaan osoittaa myös in vitro. Toisaalta tiedossa on, että tietyt mikro-RNA:t, joita on kahta muotoa (agomir ja antagomir) voivat välittää tätä toksisuutta. Perinpohjaisessa katsauksessa hahmotellaan mikro-RNA:n rakenteita, jotka voisivat toimia suojaavina. Käytännön sovellukset ovat kaukana. Mainittakoon, että äskettäin väitellyt Kiva käsitteli mikro-RNA.ta väitöskirjassaan ja toi esille tähän liittyviä käytännön ongelmia.
Erikoislaatuinen raportti, jossa on mukana Hannes Lohi Eläinlääketieteellisestä tiedekunnasta, käsittelee tietyllä koirarodulla (Weimaraners) havaittua kävelyvaikeutta, paroksysmaalista dystonia-ataksiaa. Sen laukaisee liikkuminen tai mikä hyvänsä tunnehäiriö, jolloin kävely alkaa horjua. Koko genomin kartoituksessa löytyi geneettinen muutos frameshift variantti tenaskiini-R geenissä. Ryhmä ehdottaa, että geenimuutosta kannattaisi etsiä myös neurologisilta potilailta, joiden diagnoosi on epäselvä.
Kirjoittaja on Pekka T. Männistö, LKT, farmakologian ja lääkekehityksen emeritusprofessori, Helsingin yliopisto
Kirjallisuusviitteet
1. Olfat S, Mätlik K, Kopra JJ, Garton DR, Iivanainen VH, Bhattacharya D, Jakobsson J, Piepponen TP, Andressoo JO. Increased Physiological GDNF Levels Have No Effect on Dopamine Neuron Protection and Restoration in a Proteasome Inhibition Mouse Model of Parkinson’s Disease. eNeuro. 2023 Feb 8;10(2):ENEURO.0097-22.2023. doi: 10.1523/ENEURO.0097-22.2023. Print 2023 Feb. PMID: 36690469
2. Marshall P. Finding an Optimal Level of GDNF Overexpression: Insights from Dopamine Cycling. Cell Mol Neurobiol. 2023 Oct;43(7):3179-3189. doi: 10.1007/s10571-023-01375-z. Epub 2023 Jul 6. PMID: 37410316
3. Er S, Airavaara M. Protective mechanisms by glial cell line-derived neurotrophic factor and cerebral dopamine neurotrophic factor against the α-synuclein accumulation in Parkinson’s disease. Biochem Soc Trans. 2023 Feb 27;51(1):245-257. doi: 10.1042/BST20220770. PMID: 36794783
4. Singh A, Panhelainen A, Voutilainen MH. Feasibility of combining alpha-synuclein aggregation and 6-OHDA in embryonic midbrain culture for modeling dopamine neuron degeneration. Neurosci Lett. 2023 Nov 1;816:137510. doi: 10.1016/j.neulet.2023.137510. Epub 2023 Oct 5. PMID: 37802418
5. Singh A, Panhelainen A, Reunanen S, Luk KC, Voutilainen MH. Combining fibril-induced alpha-synuclein aggregation and 6-hydroxydopamine in a mouse model of Parkinson’s disease and the effect of cerebral dopamine neurotrophic factor on the induced neurodegeneration. Eur J Neurosci. 2023 Dec 10. doi: 10.1111/ejn.16196. Online ahead of print. PMID: 38072889
6. Kulesskaya N, Bhattacharjee A, Holmström KM, Vuorio P, Henriques A, Callizot N, Huttunen HJ. HER-096 is a CDNF-derived brain-penetrating peptidomimetic that protects dopaminergic neurons in a mouse synucleinopathy model of Parkinson’s disease. Cell Chem Biol. 2023 Nov 24:S2451-9456(23)00420-8. doi: 10.1016/j.chembiol.2023.11.005. Online ahead of print. PMID: 38039968
7. Pakarinen E, Lindholm P. CDNF and MANF in the brain dopamine system and their potential as treatment for Parkinson’s disease. Front Psychiatry. 2023 Jul 24;14:1188697. doi: 10.3389/fpsyt.2023.1188697. eCollection 2023. PMID: 37555005
8. Stepanova P, Kumar D, Cavonius K, Korpikoski J, Sirjala J, Lindholm D, Voutilainen MH. Beneficial behavioral effects of chronic cerebral dopamine neurotrophic factor (CDNF) infusion in the N171-82Q transgenic model of Huntington’s disease. Sci Rep. 2023 Feb 20;13(1):2953. doi: 10.1038/s41598-023-28798-4. PMID: 36807563
9. Kovaleva V, Yu LY, Ivanova L, Shpironok O, Nam J, Eesmaa A, Kumpula EP, Sakson S, Toots U, Ustav M, Huiskonen JT, Voutilainen MH, Lindholm P, Karelson M, Saarma M. MANF regulates neuronal survival and UPR through its ER-located receptor IRE1α. Cell Rep. 2023 Feb 28;42(2):112066. doi: 10.1016/j.celrep.2023.112066. Epub 2023 Feb 3. PMID: 36739529
10. Cui H, Elford JD, Alitalo O, Perez-Pardo P, Tampio J, Huttunen KM, Kraneveld A, Forsberg MM, Myöhänen TT, Jalkanen AJ. Nigrostriatal 6-hydroxydopamine lesions increase alpha-synuclein levels and permeability in rat colon. Neurobiol Aging. 2023 Sep;129:62-71. doi: 10.1016/j.neurobiolaging.2023.05.007. Epub 2023 May 7. PMID: 37271045
11. Kilpeläinen TP, Pätsi HT, Svarcbahs R, Julku UH, Eteläinen TS, Cui H, Auno S, Sipari N, Norrbacka S, Leino TO, Jäntti M, Myöhänen TT, Wallén EAA. Nonpeptidic Oxazole-Based Prolyl Oligopeptidase Ligands with Disease-Modifying Effects on α-Synuclein Mouse Models of Parkinson’s Disease. J Med Chem. 2023 Jun 8;66(11):7475-7496. doi: 10.1021/acs.jmedchem.3c00235. Epub 2023 May 29. PMID: 37248563
12. Razzokov J, Fazliev S , Makhkamov M ,Marimuthu P, Baev A , Kurganov E. Effect of Electric Field on -Synuclein Fibrils: Revealed by Molecular Dynamics Simulations. Int. J. Mol. Sci. 2023, 24, 6312. https://doi.org/10.3390/ijms24076312
13. Alwani A, Maziarz K, Burda G, Jankowska-Kiełtyka M, Roman A, Łyszczarz G, Er S, Barut J, Barczyk-Woźnicka O, Pyza E, Kreiner G, Nalepa I, Chmielarz P. Investigating the potential effects of α-synuclein aggregation on susceptibility to chronic stress in a mouse Parkinson’s disease model. Pharmacol Rep. 2023 Dec;75(6):1474-1487. doi: 10.1007/s43440-023-00530-z. Epub 2023 Sep 19. PMID: 37725330
14. Huynh VA, Takala TM, Murros KE, Diwedi B, Saris PEJ. Desulfovibrio bacteria enhance alpha-synuclein aggregation in a Caenorhabditis elegans model of Parkinson’s disease. Front Cell Infect Microbiol. 2023 May 1;13:1181315. doi: 10.3389/fcimb.2023.1181315. eCollection 2023. PMID: 37197200
15. Gomez-Escribano A, Mora-Martınez C, Roca M , Walker DS , Panadero J, Sequedo MD ,Saini R, Knölker H-J , Blanca J, Burguera J, Lahoz A, Canizares J, Millan J, Burton NO, Schafer PV, Vazquez-Manrique RP.Changes in lipid metabolism driven by steroid signalling modulate proteostasis in C. elegans. EMBO Reports (2023) 24: e55556
16. Ohtonen S, Giudice L, Jäntti H, Fazaludeen MF, Shakirzyanova A, Gómez-Budia M, Välimäki NN, Niskanen J, Korvenlaita N, Fagerlund I, Koistinaho J, Amiry-Moghaddam M, Savchenko E, Roybon L, Lehtonen Š, Korhonen P, Malm T. Human iPSC-derived microglia carrying the LRRK2-G2019S mutation show a Parkinson’s disease related transcriptional profile and function. Sci Rep. 2023 Dec 13;13(1):22118. doi: 10.1038/s41598-023-49294-9. PMID: 38092815
17. Venediktov AA, Olga Yu Bushueva OY, Varvara A. Kudryavtseva v, Egor A. Kuzmin , Aleksandra V. Moiseeva , Anna Baldycheva , Igor Meglinski I, Gennadii A. Piavchenko G. Closest horizons of Hsp70 engagement to manage neurodegeneration. Front. Mol. Neurosci. DOI 10.3389/fnmol.2023.1230436
18. Le Guen et al. (n. 100 tekijää). Microancestor analysis of the HLA locus in Alzheimer’s and Parkinson’s diseases uncovers a shared adaptive immune response mediated by HLA-SRB1*04 subtypes. PNAS 2023:120 (36) e2302720120, https://doi.org/10.1073/pnas.2302720120
19. Minz R, Sharma PV, Negi A, Kesari KK MicroRNAs-Based Theranostics against
Anesthetic-Induced Neurotoxicity.Pharmaceutics 2023, 15, 1833. https://doi.org/10.3390/pharmaceutics15071833
20. Christen M, Gutierrez-Quintana R, James M, Faller KME, Lowrie M, Rusbridge C, Bossens K, Mellersh C, Pettitt L, Heinonen T, Lohi H, Jagannathan V, Leeb T. A TNR Frameshift Variant in Weimaraner Dogs with an Exercise-Induced Paroxysmal Movement Disorder. Mov Disord. 2023 Jun;38(6):1094-1099. doi: 10.1002/mds.29391. Epub 2023 Apr 6. PMID: 37023257