Finska prekliniska studier 2023
År 2023 publicerades 20 prekliniska studier där finska forskare medverkade. Antalet är ungefär lika stort som tidigare, det hade i varje fall inte ökat.
De vanligaste forskningsämnena var fortfarande nervtillväxtfaktorer (GDNF, MANF, CDNF; 8 artiklar). Fyra av studierna ägnades åt alfasynuklein (aSyn). Flera av studierna om nervtillväxtfaktorer tangerade också aSyn, som utan tvekan är ett centralt tema i parkinsonforskningen. Bland publikationerna fanns inga helt nya uppslag. Däremot beskrevs nya tillvägagångssätt, och nya forskningscentrum fanns representerade. Helsingfors universitet var fortfarande det överlägset viktigaste universitetet. Även Aalto-universitetet figurerade i detta sammanhang och de tekniska branscherna var representerade.
Innehållsförteckning
Nervtillväxtfaktorer
I två studier funderade man på den optimala koncentrationen av GDNF i hjärnan och problemet med höga koncentrationer. Olfat m.fl. (1) använde s.k. villkorliga GDNF-hypermorfiska möss (conditional GDNF hypermorphic mice), hos vilka koncentrationen av GDNF kan fördubblas. Forskarna konstaterade till sin förvåning att denna koncentration inte alls skyddade mössen i lactacystinmodellen mot symptom motsvarande Parkinsons sjukdom. Man studerade även vad som händer om man förhindrar att GDNF uppkommer: inget alls. Slutsatsen var att modifiering av endogen GDNF i varje fall inte påverkar lactacystinets toxicitet i hjärnan.
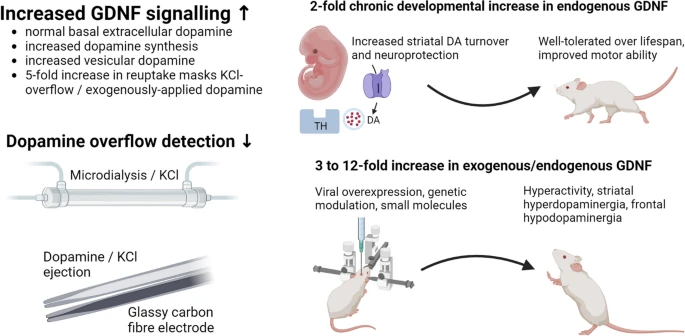
Marshall (2) kom i sin översikt fram till att en cirka dubbelt så hög koncentration av GDNF i hjärnan, externt administrerad eller endogent förhöjd, är optimal för att ha en skyddande funktion i modeller av Parkinsons sjukdom, öka dopaminfunktionen i lämplig utsträckning och verka gynnsamt på rörelsesymptom, utan alltför stor dopaminaktivitet. Mot lactacystin gäller detta uppenbarligen inte (se ovan). I den omfattande översikten gick man även igenom cellodlingsprover och olika djurförsök, där koncentrationen av GDNF höjts 3–12-faldigt. Följden blev hyperdopaminerga effekter och allvarliga rörelsestörningar hos djuren. Måttlighet är alltså bäst också i detta sammanhang.
Bild 1. Finding an Optimal Level of GDNF Overexpression: Insights from Dopamine Cycling
Er och Airavaara (3) förklarade i sin översikt hur GDNF och CDNF genom olika mekanismer minskar aggregationen av aSyn. Dessa två nervtillväxtfaktorer har ju också i övrigt sinsemellan olika struktur och påverkansmekanismer för sina skyddande effekter. Strukturerna visas nedan.
Bild 2. Om strukturerna av CDNF och GDNF


Sec. Aging Psychiatry
Volume 14 – 2023 | https://doi.org/10.3389/fpsyt.2023.1188697(siirryt toiseen palveluun)

Såsom framgår av schemat ovan, har GDNF en verkningsplats: det binder till RET-receptorerna i cellmembranet och alla effekter förmedlas via olika intracellulära signalvägar. CDNF anges på flera ställen i schemat och verkar på åtminstone tre sätt: 1) det hindrar fibrillerna från att ta sig in i cellen (internalisation), 2) CDNF binder direkt till aSyn och hindrar dess fördubbling (dimerisation) och 3) CDNF påverkar även de intracellulära nätverken, vilket stör aSyn-aggregationen. Oavsett vilken mekanism det rör sig om, är nervtillväxtfaktorernas inverkan på aggregation av aSyn en nyttig bimekanism med tanke på behandling av Parkinsons sjukdom.
Voutilainens forskningsgrupp har studerat samverkan mellan en aSyn-fibrillmodell och 6-OHDA, både i celler från mellanhjärnan hos möss (4) och i försök med möss (5). I cellodlingarna ledde fibriller i sig, ens i stora mängder, inte till att dopaminceller förstördes. Däremot fungerade 6-OHDA. Med kombinationen överskreds inte 6-OHDA:s toxiska verkan. CDNF inverkade inte på kombinationens toxicitet, men hade en liten skyddande verkan mot bara 6-OHDA. I musmodellen injicerades förhandstillverkade fibriller två veckor före 6-OHDA, och man testade tre olika doser på en sida i närheten av s. nigra. En dos på 2 µg visade sig vara den mest optimala. Mössen testades vid 14 veckor. Kombinationen av giftämnen gav upphov till en betydande dopaminskada, och äldre möss (2–4 månader) var känsligare än unga (7–9 veckor). CDNF-infusion i striatum lindrade toxiciteten av 6-OHDA, men hade ingen effekt i fibrill+6-OHDA-gruppen. Toxiciteten av 6-OHDA föreföll vara större när aggregaten var stora. Resultatet av behandlingsprövningen är inte särskilt uppmuntrande, men å andra sidan kan kombinationens toxicitet vara mycket stor och svårbehandlad.
Huttunens forskningsgrupp (6) rapporterade om ett nytt CDNF-deriverat (storlek 18 kDa) peptidomimetikum (HER-096; storlek cirka 1 kDa, struktur nedan) som absorberas vid subkutan administrering och når hjärnan i lämplig mängd. Ämnets farmakokinetik är blygsam. T1/2 är cirka 30 min., i hjärnan eventuellt längre. I flera av de olika försöken in vitro fungerar HER-096 lika bra som CDNF eller GDNF: skyddar dopaminceller, hindrar aSyn-aggregation och modifierar UPR-responsen (respons på oveckade proteiner, som har att göra med toxisk oxidativ stress inne i cellerna). När föreningen administreras under huden tre gånger om dagen (10 mg/kg), fungerar den på väntat sätt även i aSyn-fibrillmodellens äldre möss, och förbättrar deras förmåga att balansera på en roterande stav. Andra egentliga grundläggande Parkinson-försök rapporteras åtminstone inte. Herantis har inlett kliniska prövningar med HER-096 (fas 1).
Bild 3. Om HER-096 strukturen


Pakarinen och Lindholm (7) tittar i sin översikt närmare på potentialen hos CDNF och MANF inom behandling av Parkinsons sjukdom, i ljuset av en mångfald rapporterade cellprover och djurförsök. Det är en omfångsrik text där man i tabeller sammanställt praktiskt taget alla rön som publicerats under de senaste tio åren. Det är utmärkt att man även inkluderat rön som avviker från huvudfåran. Mellan djurarter och cellinjer finns svårförklarade skillnader. Tillväxtfaktorer fungerar inte i alla modeller. Det finns fortfarande kunskapsluckor.
Författarna har också förklarat bl.a. nervtillväxtfaktorers påverkansmekanismer, något som vi tagit upp ovan (3). I översikten behandlas inga patientprövningar. Det är en bra lösning, eftersom de anspråkslösa behandlingsresultaten inte ger någon anledning till stor optimism.
Voutilainens forskningsgrupp har studerat effekten av CDNF i en transgen musmodell av Huntingtons sjukdom (N171-82Q; 8). Modellen omfattar 82 upprepningar av glutamin i huntingtin-fragment, och den torde vara en av de bästa för sitt syfte, åtminstone bättre än en kinolinmodell. CDNF-protein (3 µg/24 h) infunderades i striatum med Alzet-minipumpar i fyra veckors tid. Mössen var 11 veckor gamla när försöket inleddes, och avlivades när de var 15 eller 16 veckor gamla. CDNF-infusionen minskade inte antalet aggregat, men fördröjde i någon mån uppkomsten av rörelsesymptomen. Något överraskande ökade koncentrationen av BDGF (brain-derived neurotropic factor) i striatum. Aggregaten analyserades med en finsk metod som bygger på artificiell intelligens (deep learning neural network Aiforia), vilket i sig är en prestation.
Saarmas forskningsgrupp (Kovaleva m.fl.; 9) har nya tankar om hur MANF fungerar. MANF finns i det endoplasmatiska nätverket inne i cellen, där det skyddar nervcellerna mot oxidativa skador. Nu har man visat att MANF inverkar direkt på sensorn IRE1⍺ som förmedlar UPR-svar, detta protein fungerar alltså som receptor för MANF. Vid UPR (Unfolded Protein Response), alltså respons på oveckade proteiner, fungerar det endoplasmatiska nätverket som förmedlare av toxisk oxidativ stress. I nätverket finns proteinet BiP, som gärna binder till IRE1⍺, och MANF tävlar om denna bindning. När MANF avgår med segern aktiveras många fördelaktiga reaktioner och celldöd undviks. I serien av undersökningar gjordes, utöver många bindningsförsök, även ett flertal mutationer av MANF, genom vilka man fastställde specificitet och förutsättningar för bindning av MANF och IRE1⍺. Observationerna säkerställdes därtill genom 6-OHDA-försök i en råttmodell av Parkinsons sjukdom.
Bild 4. MANF-funktion

Studier som rör alfasynuklein (aSyn)
Nervtillväxtfaktorers effekter på aSyn har redan beskrivits ovan, men även andra synvinklar har studerats.
Cui m.fl. (10) studerade tarm-hjärna-axelns funktion genom en 6-OHDA-råttmodell. Tarmens genomsläpplighet och mängden aSyn utreddes fem veckor efter att toxinet administrerats. aSyn och fosforyliserad aSyn ökade i tjocktarm, tunntarm och på lesionssidan av hjärnan. Även vissa proteiner i ileum och colon ökade som tecken på tarmens genomsläpplighet. Slutsatsen är att tarm-hjärna-axeln verkar i båda riktningarna och att processen också kan börja i hjärnan och därefter framskrida till tarmen. Vagusnerven (n. vagus) har en nyckelposition i denna trafik, detta är känt sedan länge.
Kilpeläinen m.fl. (11) utvecklade icke-peptidiska PREP-hämmare, varav en (HUP-55) studerades i aSyn-fibrill- (överföring med hjälp av virusvektorer till hjärnan) och aSyn-transgena musmodeller. Som med tidigare PREP-ligander, förbättrade den nya föreningen försämrad motorik och sänkte koncentrationerna av aSyn-oligomerer i striatum och s. nigra. Det är frågan om en syntetisk-kemisk publikation och föreningarna har patenterats.
En forskare från Åbo Akademi (Marimuthu) medverkade i en uzbekisk forskningsgrupp som utredde på vilket sätt elektriska fält påverkar uppkomsten av aSyn-fibriller (12). Man ville ta reda på om det är möjligt att hindra eller omvandla bildningen av fibriller med hjälp av ett externt elektriskt fält. Försöken gjordes med molekyldynamisk simulering, och det visade sig verkligen vara möjligt att förändra fibrillernas konformation. Fibrillernas hydrofobiska kärna såg ut att öppna sig. Man kunde fastställa det elektriska fältets exakta styrka. Vägen till praktiska tillämpningar är kanske inte så lång, eftersom parametrarna ligger ganska nära de som används vid djup hjärnstimulering (DBS). Dock är det inte känt hur klassisk DBS påverkar fibriller. Faktiskt vet man inte ens om elektriska fälts effekter på fibriller är till nytta eller skada.
Betydelsen av aSyn-aggregat för beteendet hos möss har undersökts ur ett något nytt perspektiv. Alwani m.fl. (13) injicerade aSyn-fibriller i båda striata och mätte efter tre månader mössens beteende och reaktioner på långvarig social stress. Mössen blev mer aktiva vid vistelse i ett öppet utrymme och mindre ångestfyllda i en mörker/ljus-cykel. De uppvisade ökad aktivitet i tail-suspension-testet (mäter depression). Med andra ord verkade injektionen av aSyn-fibriller i sig förbättra mössens allmänna kognitiva välmående. Stresskänsligheten förändrades inte alls. Aggregatbildning märktes främst i amygdala, prefrontala cortex och s. nigra, och minst i 5-HT- och noradrenalin-neuronernas utgångskärnor (rafe-kärnan, locus coeruleus). Det verkar alltså, överraskande nog, vara så att aSyn-aggregationer, vid sidan av att orsaka dopaminerg skada, har kompensatorisk verkan på kognitiva funktioner. Observationen får oss att fundera på olika aspekter av den allt vanligare Parkinsons-fibrillmodellen.
Bakgrunden till bildningen av aSyn-aggregat har också studerats via bakteriologisk etiologi. I en studie som avviker från huvudfåran samlade Huynh m.fl. (14) in avföringsprover från parkinsonpatienter och deras friska partner, och isolerade bakterier ur en stam av desulfovibrio-bakterier. Det finns redan vissa belägg för att just denna stam skulle kunna spela en viktig roll för Parkinsons sjukdom. Isolerade bakterier från parkinsonpatienter och friska kontrollpersoner användes som föda för rundmaskar (C. elegans). I jämförelsen ingick även ett par E. coli-stammar, som hade en speciell förmåga att producera aggregat. Parkinsonpatienternas bakterier orsakade inom fyra dagar betydligt fler och större aggregationer än bakterierna från kontrollpersonerna. Den förstnämnda gruppens maskar dog också tidigare. Denna studie stöder tesen att just desulfovibrio-bakterier bland tarmbakterier spelar en central roll för bildningen av aSyn-aggregation, och kanske har betydelse för uppkomsten av Parkinsons sjukdom. Nu har man bara studerat rundmaskar, så vi väntar med intresse på djurförsök på högre nivå.
Rundmaskar användes även i en studie av Gómez-Escribano m.fl. (15). Bland de spanska forskarna fanns Mora-Martínez som verkar i Finland. De sållade ut mutationer hos C. elegans vilka särskilt skulle orsaka proteinaggregation. Man hittade bl.a. en viss mutation, en stomatinhomolog, UNC‑1. Efter komplexa skeden lade den till polyglutaminrepetitioner (polyQ). En annan kärnreceptor, DAF‑12, fungerar som en antagonist. I fortsatta studier konstaterades att UNC‑1 är associerad med sulfotransferaser och fettmetabolism. Slutsatsen är att en grupp enzymer som är involverade i fettmetabolismen skulle kunna fungera som objekt vid sökning av nya läkemedelssubstanser mot neurodegenerativa sjukdomar i hjärnan.
Andra prekliniska studier
Lehtonens/Koistinahos forskningsgrupp har fortsatt sin stamcellsbaserade forskning (Ohtonen m.fl.; 16). Pluripotenta stamceller producerades ur mikrogliaceller (iMGLs). I dessa iMGLs har man nu gjort en LRRK2-mutation som är ett tecken på Parkinsons sjukdom. Dessa celler jämfördes med mikroglier som isolerats från parkinsonpatienter, och betydande likheter observerades. Forskarna rekommenderar nu att man drar nytta av dessa celler vid studier av mikrogliers betydelse för uppkomsten av Parkinsons sjukdom. Det bör nämnas att denna rapport torde ingå i det s.k. minibrain-tänkandet, enligt vilket man skulle kunna bygga en modell av hjärnan med hjälp av stamcellsderiverade cellmodeller.
En grupp som främst består av ryska forskare (17), däribland Igor Meglinski som arbetar i Uleåborg, har i en omfattande översikt behandlat s.k. värmechockproteiner, särskilt Hsp70 och Hsp90 vid neurodegenerativa sjukdomar. Hsp70 ser ut att vara en skyddande faktor. Mängden Hsp70 kan ökas med några kända läkemedelssubstanser (riluzol, pioglitazon, kolkicin) eller genom gentransplantation. Översikten är grundlig och innehåller omfattande tabeller. Reella behandlingar eller andra sätt att påverka dessa proteiner finns egentligen inte ännu. De kliniska exemplen har svag beviskraft. Vi befinner oss på teoretisk nivå.
I en artikel av cirka 100 forskare (18), bland andra forskare från Kuopio, behandlas den skyddande effekten av en viss HLA (human leucocyte antigen), HLA-DRB1*04, bl.a. vid Parkinsons sjukdom. En del av dessa proteiner binder Tau-proteinet. Ett fragment av Tau (PHF6) är involverat i bildningen av aggregat om det är acetylerat (alltså a-PHF6). Tanken förefaller vara att vaccinera med a-PHF6, så att ingen aggregation sker. Vi får se hur situationen utvecklas.
Forskare vid Aalto-universitet deltar i en sällsynt mikro-RNA-översikt (Negi, Kesaris; 19). Bakgrunden till detta är en nervtoxicitet som orsakas av många substanser för narkos och som även kan påvisas in vitro. Å andra sidan vet man att vissa mikro-RNA som har två former (agomir och antagomir) kan förmedla denna toxicitet. I denna grundliga översikt beskrivs strukturer hos mikro-RNA, vilka skulle kunna tänkas ha en skyddande funktion. Det är fortfarande långt kvar till praktiska tillämpningar. Det ska också nämnas att Julia Kiva, som nyligen disputerade, i sin avhandling behandlade mikro-RNA och tog upp relaterade praktiska problem.
En särartad rapport, med medverkan av Hanne Lohi vid veterinärmedicinska fakulteten, handlar om en gångsvårighet som observerats hos en viss hundras (Weimaraner), paroxysmal dystoni-ataxi. Symptomen utlöses av rörelse eller någon emotionell rubbning, varvid hunden uppvisar en vinglande gång. Genom kartläggning av hela genomet hittades genförändringen Frameshift-mutation i tenaskin-R-genen. Enligt forskningsgruppen skulle det kunna vara en bra idé att söka efter genförändringar hos neurologiska patienter med oklar diagnos.
Författaren är Pekka T. Männistö, (MD), emeritusprofessor i farmakologi och läkemedelsutveckling vid Helsingfors universitet.
Preklinisk litteratur
1. Olfat S, Mätlik K, Kopra JJ, Garton DR, Iivanainen VH, Bhattacharya D, Jakobsson J, Piepponen TP, Andressoo JO. Increased Physiological GDNF Levels Have No Effect on Dopamine Neuron Protection and Restoration in a Proteasome Inhibition Mouse Model of Parkinson’s Disease. eNeuro. 2023 Feb 8;10(2):ENEURO.0097-22.2023. doi: 10.1523/ENEURO.0097-22.2023. Print 2023 Feb. PMID: 36690469
2. Marshall P. Finding an Optimal Level of GDNF Overexpression: Insights from Dopamine Cycling. Cell Mol Neurobiol. 2023 Oct;43(7):3179-3189. doi: 10.1007/s10571-023-01375-z. Epub 2023 Jul 6. PMID: 37410316
3. Er S, Airavaara M. Protective mechanisms by glial cell line-derived neurotrophic factor and cerebral dopamine neurotrophic factor against the α-synuclein accumulation in Parkinson’s disease. Biochem Soc Trans. 2023 Feb 27;51(1):245-257. doi: 10.1042/BST20220770. PMID: 36794783
4. Singh A, Panhelainen A, Voutilainen MH. Feasibility of combining alpha-synuclein aggregation and 6-OHDA in embryonic midbrain culture for modeling dopamine neuron degeneration. Neurosci Lett. 2023 Nov 1;816:137510. doi: 10.1016/j.neulet.2023.137510. Epub 2023 Oct 5. PMID: 37802418
5. Singh A, Panhelainen A, Reunanen S, Luk KC, Voutilainen MH. Combining fibril-induced alpha-synuclein aggregation and 6-hydroxydopamine in a mouse model of Parkinson’s disease and the effect of cerebral dopamine neurotrophic factor on the induced neurodegeneration. Eur J Neurosci. 2023 Dec 10. doi: 10.1111/ejn.16196. Online ahead of print. PMID: 38072889
6. Kulesskaya N, Bhattacharjee A, Holmström KM, Vuorio P, Henriques A, Callizot N, Huttunen HJ. HER-096 is a CDNF-derived brain-penetrating peptidomimetic that protects dopaminergic neurons in a mouse synucleinopathy model of Parkinson’s disease. Cell Chem Biol. 2023 Nov 24:S2451-9456(23)00420-8. doi: 10.1016/j.chembiol.2023.11.005. Online ahead of print. PMID: 38039968
7. Pakarinen E, Lindholm P. CDNF and MANF in the brain dopamine system and their potential as treatment for Parkinson’s disease. Front Psychiatry. 2023 Jul 24;14:1188697. doi: 10.3389/fpsyt.2023.1188697. eCollection 2023. PMID: 37555005
8. Stepanova P, Kumar D, Cavonius K, Korpikoski J, Sirjala J, Lindholm D, Voutilainen MH. Beneficial behavioral effects of chronic cerebral dopamine neurotrophic factor (CDNF) infusion in the N171-82Q transgenic model of Huntington’s disease. Sci Rep. 2023 Feb 20;13(1):2953. doi: 10.1038/s41598-023-28798-4. PMID: 36807563
9. Kovaleva V, Yu LY, Ivanova L, Shpironok O, Nam J, Eesmaa A, Kumpula EP, Sakson S, Toots U, Ustav M, Huiskonen JT, Voutilainen MH, Lindholm P, Karelson M, Saarma M. MANF regulates neuronal survival and UPR through its ER-located receptor IRE1α. Cell Rep. 2023 Feb 28;42(2):112066. doi: 10.1016/j.celrep.2023.112066. Epub 2023 Feb 3. PMID: 36739529
10. Cui H, Elford JD, Alitalo O, Perez-Pardo P, Tampio J, Huttunen KM, Kraneveld A, Forsberg MM, Myöhänen TT, Jalkanen AJ. Nigrostriatal 6-hydroxydopamine lesions increase alpha-synuclein levels and permeability in rat colon. Neurobiol Aging. 2023 Sep;129:62-71. doi: 10.1016/j.neurobiolaging.2023.05.007. Epub 2023 May 7. PMID: 37271045
11. Kilpeläinen TP, Pätsi HT, Svarcbahs R, Julku UH, Eteläinen TS, Cui H, Auno S, Sipari N, Norrbacka S, Leino TO, Jäntti M, Myöhänen TT, Wallén EAA. Nonpeptidic Oxazole-Based Prolyl Oligopeptidase Ligands with Disease-Modifying Effects on α-Synuclein Mouse Models of Parkinson’s Disease. J Med Chem. 2023 Jun 8;66(11):7475-7496. doi: 10.1021/acs.jmedchem.3c00235. Epub 2023 May 29. PMID: 37248563
12. Razzokov J, Fazliev S, Makhkamov M, Marimuthu P, Baev A , Kurganov E. Effect of Electric Field on -Synuclein Fibrils: Revealed by Molecular Dynamics Simulations. Int. J. Mol. Sci. 2023, 24, 6312. https://doi.org/10.3390/ijms24076312
13. Alwani A, Maziarz K, Burda G, Jankowska-Kiełtyka M, Roman A, Łyszczarz G, Er S, Barut J, Barczyk-Woźnicka O, Pyza E, Kreiner G, Nalepa I, Chmielarz P. Investigating the potential effects of α-synuclein aggregation on susceptibility to chronic stress in a mouse Parkinson’s disease model. Pharmacol Rep. 2023 Dec;75(6):1474-1487. doi: 10.1007/s43440-023-00530-z. Epub 2023 Sep 19. PMID: 37725330
14. Huynh VA, Takala TM, Murros KE, Diwedi B, Saris PEJ. Desulfovibrio bacteria enhance alpha-synuclein aggregation in a Caenorhabditis elegans model of Parkinson’s disease. Front Cell Infect Microbiol. 2023 May 1;13:1181315. doi: 10.3389/fcimb.2023.1181315. eCollection 2023. PMID: 37197200
15. Gomez-Escribano A, Mora-Martınez C, Roca M, Walker DS, Panadero J, Sequedo MD, Saini R, Knölker H-J, Blanca J, Burguera J, Lahoz A, Canizares J, Millan J, Burton NO, Schafer PV, Vazquez-Manrique RP.Changes in lipid metabolism driven by steroid signalling modulate proteostasis in C. elegans. EMBO Reports (2023) 24: e55556
16. Ohtonen S, Giudice L, Jäntti H, Fazaludeen MF, Shakirzyanova A, Gómez-Budia M, Välimäki NN, Niskanen J, Korvenlaita N, Fagerlund I, Koistinaho J, Amiry-Moghaddam M, Savchenko E, Roybon L, Lehtonen Š, Korhonen P, Malm T. Human iPSC-derived microglia carrying the LRRK2-G2019S mutation show a Parkinson’s disease related transcriptional profile and function. Sci Rep. 2023 Dec 13;13(1):22118. doi: 10.1038/s41598-023-49294-9. PMID: 38092815
17. Venediktov AA, Olga Yu Bushueva OY, Varvara A. Kudryavtseva v, Egor A. Kuzmin , Aleksandra V. Moiseeva , Anna Baldycheva , Igor Meglinski I, Gennadii A. Piavchenko G. Closest horizons of Hsp70 engagement to manage neurodegeneration. Front. Mol. Neurosci. DOI 10.3389/fnmol.2023.1230436
18. Le Guen et al. (n. 100 tekijää). Microancestor analysis of the HLA locus in Alzheimer’s and Parkinson’s diseases uncovers a shared adaptive immune response mediated by HLA-SRB1*04 subtypes. PNAS 2023:120 (36) e2302720120, https://doi.org/10.1073/pnas.2302720120
19. Minz R, Sharma PV, Negi A, Kesari. KK MicroRNAs-Based Theranostics against Anesthetic-Induced Neurotoxicity.Pharmaceutics 2023, 15, 1833. https://doi.org/10.3390/pharmaceutics15071833
20. Christen M, Gutierrez-Quintana R, James M, Faller KME, Lowrie M, Rusbridge C, Bossens K, Mellersh C, Pettitt L, Heinonen T, Lohi H, Jagannathan V, Leeb T. A TNR Frameshift Variant in Weimaraner Dogs with an Exercise-Induced Paroxysmal Movement Disorder. Mov Disord. 2023 Jun;38(6):1094-1099. doi: 10.1002/mds.29391. Epub 2023 Apr 6. PMID: 37023257